QUIMICA II
NUESTRO EQUIPO CONFORMADO POR GUADALUPE RAMIREZ, MARIA SAMANO, GUADALUPE MERCADO Y MIRIAM MENDOZA. REALIZAMOS LA CONTINUACION DE NUESTRO BLOG PARA LA CLASE DE QUIMICA II. ESPEREMOS SEA DE SU AGRADO.
BLOQUE I: REACCIONES QUIMICAS
Definición de reacción química:
Es aquel suceso químico en el cual dos sustancias o mas denominadas reactivas, por la acción de un factor energético se convierte en otras sustancias designadas como productos.
(Martines,2013)
EJEMPLOS DE REACCIONES QUIMICAS.
Encendido de un cerillo.
Debido a la combustión producida por 2 óxidos importantes el fósforo y oxigeno gaseoso, esto es lo que produce una liberación de gran cantidad de energía.
(Martinez,2013)
Reacción química en un ¨pastel
En cada paso dentro de la preparación de un pastel, ocurren un serie de cambios físicos a químicos.
cuando las yemas al estar en contacto con el aire se modifican en interacciones hidrofobicas al desnaturalizas las proteínas del huevo, estas ayudan a enlazar el pastel.
en cambio la harina es un emulsionante químico que reacciona con los ingredientes anteriores y produce un gas el cual hace que quede esponjoso.
(Alvares,2015)
 |
| https://s-media-cache-ak0.pinimg.com/236x/33/af/a4/33afa4ab35e19dd469db122b87b20d29.jpg |
Reacción de digestion de los alimentos.
La digestion como bien sabemos es el proceso de trasformacion de los alimentos previamente ingeridos, en sustancias mas sencillas para ser absorbidos.
(Reaccionesquimicas,2014)
 |
| http://recursos.cnice.mec.es/biosfera/alumno/3ESO/diges/img/Digestion.gif |
Reacción química en la respiración
Cuando se contrae el diafragma, los musculos pectorales menores y los intercostales externos, la cavidad torácica y los pulmones se expanden y el arie entra con rapidez en los pulmones mediante las vías respiratorias y llenan el vacío resultante.
(Ramos,2013)
Proceso químico en el amor.
Desde el punto de vista bioquímico, el enamoramiento comienza en la corteza cerebral .
posteriormente pasa al sistema endocrino y se trasforma en una respuesta fisiológica y en cambios químicos originados por la segregación de dopamina en el hipotálamo.
(Procesoquimicodelamor,2016)
 |
| https://thumbs.dreamstime.com/z/chemistry-love-vector-illustration-color-49351083.jpg |
ECUACION QUIMICA
Reactivo 1 + Reactivo 2 ----> Producto
Reactivos: Sustancias que interactuan entre si en una reacción química, se escriben en el lado izquierdo de la ecuación química.
(Daud, 2015)
Productos: Sustancias que se forman durante una reacción química, se escriben en el lado derecho de la ecuación química.
(Daud, 2015)
 |
| http://fyq15-16.weebly.com/uploads/5/6/8/0/56804499/797564069.png |
Catalizador: Sustancia que modifica la velocidad (acelera) de una reacción química y que el termino de esta se recupera sin cambio.
(Johns,2012)
COMO LEER UNA ECUACION
2H 2 (g) + O2 (g) ---> 2H 2O (g)
Se lee: Dos moleculas de hidrogeno gaseoso reacciona con una molecula de oxigeno gaseoso para producir 2 moleculas de agua gaseosa.
TIPOS DE REACCIONES QUIMICAS
Síntesis: ocurre cuando 2 o mas sustancias (elementos o compuestos) reaccionan para producir una sustancia.
¨¨A las reacciones en las que interviene el gas oxigeno, también se les llama REACCIONES DE COMBUSTION, porque la combustión es la reacción entre el oxigeno y otras sustancias.
Carbono + Hidrogeno + Oxigeno --->
 |
| http://image.slidesharecdn.com/reaccionesquimicas-111006212343-phpapp01/95/quimica-reacciones-quimicas-11-728.jpg?cb=1317936285 |
Descomposición: ¨¨Contraria a la de sitesis
En estas reacciones una sustancia sufre una transformación para formar 2 o mas sustancias. La sustancia que se rompe primero es un compuesto y los productos pueden ser elementos o compuestos. Muchas veces se necesita calor.
Algunos compuestos se descomponen para producir oxigeno gaseoso.
ELABORADO POR:MIRIAM MENDOZA CABRERA
SUSTITUCION SENCILLA
Un metal (A) sustituye a un ion metaico en su sal o acido, B puede ser un ion metálico o un ion hidrogeno.
A + BZ---> AZ + B
es posible acomodar los metales en un orden que se llama serie electromotriz o de actividad cada elemento de la serie desplazara a cualquier otro, que lo siga, de su sal o acido.
Serie de actividad de los metales:
Li, K, Ba, Ca, Na, Mg, Al, Zn, Fe, Cd, Ni, Sn, Pb, (H), Cu, Hg, Ag, Au.
serie de actividad de los halógenos:
F2, Cl2, Br2, I2
los metales mas reactivos (Li, K, Ba, Ca, y Na) sustituyen a un hidrogeno del agua para formar hidroxido metalico y gas hidrogeno.
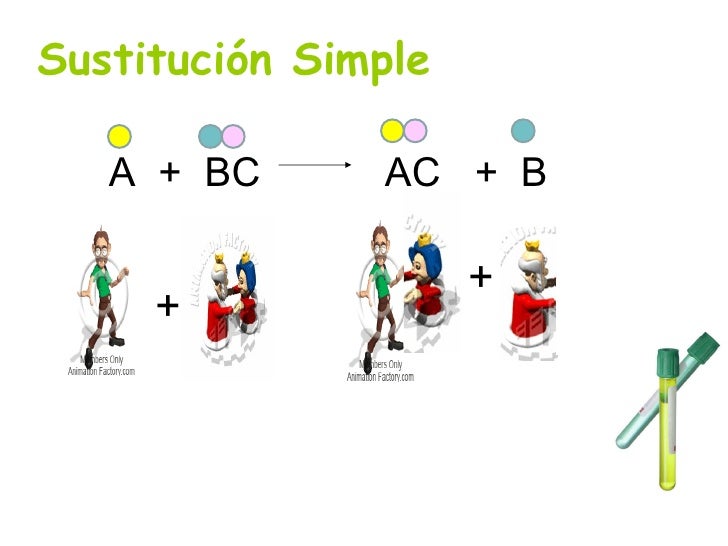 |
| http://image.slidesharecdn.com/reaccionesquimicas-111006212343-phpapp01/95/quimica-reacciones-quimicas-20-728.jpg?cb=1317936285 |
REACCIONES DE DOBLE DESPLAZAMIENTO.
Participan dos compuestos en la reacción, el ion positivo (catión) de un compuesto se intercambian con el ion positivo (catión) del otro compuesto.
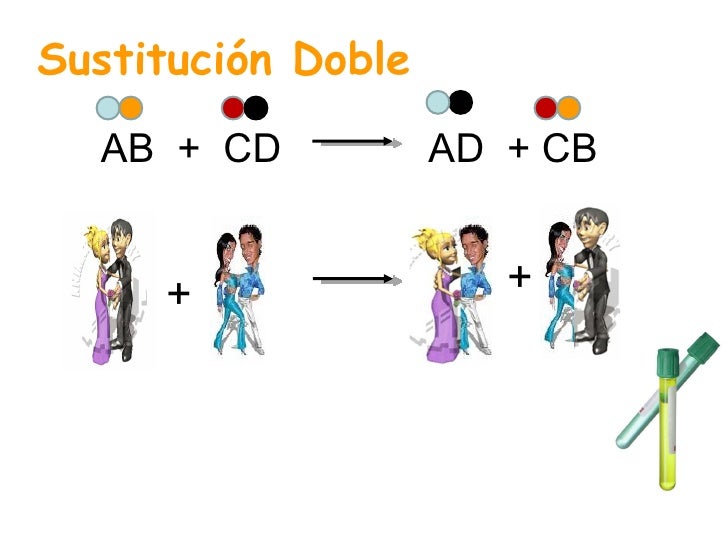 |
| http://image.slidesharecdn.com/reaccionesquimicas-111006212343-phpapp01/95/quimica-reacciones-quimicas-24-728.jpg?cb=1317936285 |
REACCIONES DE NEUTRALIZACION
Es una reacción entre un acido y una base generalmente en las reacciones acuosas acido•base se forma agua y una sal, que es un compuesto ionico formado por un catión distinto del H+ y un anión distinto del OH- u O-2
Acido + base ---> sal + agua
 |
| http://image.slidesharecdn.com/tipodereaccionesquimicastema2-140828173500-phpapp01/95/tipo-de-reacciones-quimicas-tema-2-8-638.jpg?cb=1409247334 |
REACCIONES DE COMBUSTION
Se requiere oxigeno y con frecuencia la reacción produce un oxido agua y calor.
 |
| http://image.slidesharecdn.com/c24s11tiposdereaccionesqumicas-120513184142-phpapp02/95/c24-s11-tipos-de-reacciones-qumicas-7-728.jpg?cb=1336934611 |
INFORMACION SACADA DE:(Química estructura y dinámica,2015)
BALANCEO DE ECUACIONES
METODO TANTEO:
La ecuación obtenida, consiste en verificar que todos los compuestos u elementos clasificados en reactivos y productos queden balanceados.
primero se verifica cuantos reactivos(lado izquierdo) están entrando y se pone junto con el elemento, ejemplo 4 Na, siguiendo así con todos los elementos encontrados en la ecuación. después de obtener los reactivos, se buscan los productos (derecho) ejemplo 4 (reactivo)Na 5(producto).
obteniendo esta tabla se verifica de que lado ha quedado desvalanceado dando preferencia al menor numero (en este ejemplo seria el reactivo), siendo así se busca el numero el cual quede balanceado el reactivo y producto.
ejemplos:
Metano + Oxigeno produce Dioxido de carbono + agua.
CH4+ O2 REACTIVOS---> PRODUCTOSCO2 + 2H2O
1 C 1
4 H 2= 4
2 O 1= 2
2 ES EL NUMERO QUE SE OBTUVO PARA QUE LA ECUACION QUEDE TOTALMENTE BALANCEADA.
METODO ALGEBRAICO
ELABORADO POR:GUADALUPE MERCADO NAVARRETE
METODO REDOX
1. El numero de oxidacion de un elemento libre es cero.
2. El numero de oxidacion de los metales en los compuestos es igual a su valencia ioniza. por ejemplo los metales alcalinos tienen un numero de oxidación de 1+ los metales alcalinoterreos de 2+ y siempre es positiva algunos metales tienen valencia única pero otros tienen valencia variable y esos los encontramos en el bloqueo de los metales de transición.
3. El numero de oxidacion de un ion es igual a su carga
4. El numero de oxidacion del hidrogeno en la mayoría de los compuestos es de 1+ excepto en los hidruros metálicos, que son compuestos en donde el hidrogeno se une al metal y es este caso donde el hidrogeno es 1-.
FORMULA GENERAL PARA ALCANOS.
PREFIJO ANO
CnH2n+2
met-1
et-2 formula A+ B- ANION_CATION
prop-3
but-4
pent-5
hexa-6
penta-7
INFORMACION SACADA DE LA CLASE DE QUIMICA II, IMPARTIDA POR LA ING.HILDA CISNEROS
VELOCIDAD DE REACCION.
La transformación química de un objeto en un determinado lapso de tiempo, transformándolo totalmente.
Tres condicione requeridas para que ocurra la reacción,
Colisión, Orientación y energia.
 |
| http://image.slidesharecdn.com/tema2reaccionesquimicas-131120161419-phpapp02/95/reacciones-qumicas-4-eso-19-638.jpg?cb=1385089623 |
La velocidad de reacción se determina al medir la cantidad de un reactivo agotado o la cantidad de un producto formado, en un determinado tiempo.(Factores que afectan la velocidad de reacción,2016)
FACTORES QUE AFECTAN LA VELOCIDAD DE REACCION
CONCENTRACION. se refiere a la cantidad de solito que hay en una masa o volumen determinado de solución o solvente. puesto que terminamos como concentrado, diluido, saturado o insaturado, son inespecificos. existen maneras de expresar exactamente a la cantidad de solito en una solución. (MENDEZ, 2014)
| https://lh5.googleusercontent.com/v2n1AIg4KzdGLwjV6qNtrZvNmX4kcmTRl8ovKEaLtwjiwM5Gk2Dl9NnV79bPZ-Jglxu71OYk3ene1h4jPdS9LbhjL_qhPS92mM1lPYzYU2vExezxgweRr4AU53VcbF489Jl0X-Q |
TEMPERATURA. Suele afectar de una manera bastante notable a la velocidad de las reacciones químicas. por lo general un aummneto de la temperatura condiciona un aumento de velocidad de reacción.(MENDEZ, 2014)
 |
| https://userscontent2.emaze.com/images/3813351e-2eef-41fe-a3ce-991ee1c242de/573dbfc7-9b32-43da-8edf-2405b90fec02.jpg |
CATALIZADOR. Es una sustancia que aumenta la velocidad de la reacción química, participando en la misma reacción pero si consumirse, por lo tanto la cantidad de catalizadores que hay es mínima tanto al principio como al final del proceso. los catalizadores no afectan al estad de equilibrio de un sistema químico, pues únicamente secta la velocidad con la que se llega al equilibrio químico. (MENDEZ 2014)
 |
| http://conceptodefinicion.de/wp-content/uploads/2014/07/catanegativo.png |
PRESION. Cuando los reactivos químicos están en el mismo estado ambos disueltos en un mismo liquido, el aumento de la concentración de uno o mas reactivas normalmente aumenta la velocidad de reacción a un cierto grado, ya que habrá mas moléculas para reaccionar por unidad de tiempo. El grado en el que la reacción se acelera, depende del orden particular de la reacción. (MENDEZ 2014)
 |
| http://www.monografias.com/trabajos96/reaccion-fase-gaseosa/image003.jpg |
TAMAÑO DE PARTICULA. Cuanto mas partículas estén los reactivas mayor será la probabilidad de contacto entre ellos por lo que aumenta la velocidad de reacción.(Mendez,2014)
NATURALEZA QUIMICA. Naturaleza de reactivos-dependiendo del tipo de reactivo que intervenga, una determinada reacción tendrá una energía de activación.
MUY ALTA, ENTONCES SERA MUY LENTA
MUY BAJA, ENTONCES SERA MUY RAPIDA
(Mendez, 2014)
ELABORADO POR:MARIA DEL CARMEN SAMANO LULE
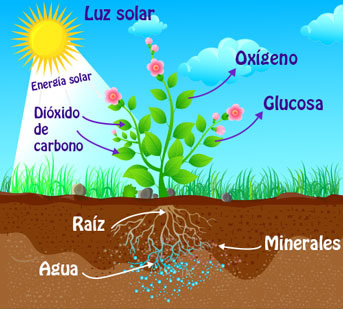
Es un proceso que transforma la energia de la luz del sol en la elaboracion de azucares de CO2 dioxido de carbono minerales y agua con la ayuda de luz solar.
FACTORES
Luz
Agua
Dioxido de carbono
Pigmentos
Temperatura
REACCION QUIMICA
Se da en organismos con clorofila, capturan energia en forma de luz y la transforman en energia quimica. prácticamente toda la energía ue consume la vida de la biosferaterrestre.
FACTORES QUE MODIFICAN LA VELOCIDAD DE FOTOSINTESIS
Intensidad de la luz
Concentracion de dioxido de carbono
Temperatura
Una luz de intensidad extensiva podría destruir la clorofila. Las variaciones de temperatura provocan cambios a la velocidad de la luz. (Fotosíntesis,2016)
LLUVIA ACIDA
Es una forma de contaminación acida que hace referencia a la caída de ácidos presentes en la atmósfera , atravez de la lluvia, niebla y nieve.
Las precipitaciones acidas disminuyen la reserva mineral del suelo. Sobre terrenos calcáreos, la calceta de las rocas neutraliza en los suelos siliceos, por lo contrario la acides aumenta.(Téllez,2016)
 |
| http://userscontent2.emaze.com/images/37d32c46-79d6-406a-852f-7cab52ee71c6/d01d967d-e2d9-4716-a772-a98799ef1e38.png |
REACCION QUIMICA
Los ácidos, acido sulfúrico y acido nitrico se disuelven en las gotas de agua que forman las nubes, depositandose en el suelo, ambos ácidos se forman en la atmósfera al reaccionar el trióxido de azufre y dióxido de nitrógeno con agua oxigeno y otras sustancias químicas presentes. En presencia de luz estas reaccionan y aumenta la velocidad de estas reacciones
SO3 H2O H2SO4 ACIDO SULFURICO
FABRICACION DE ACIDOS SULFURICOS Y FERTILIZANTES
Existen dos procesos para la obtención de acido sulfúrico ;
Camaras de plomo. se utiliza para producir gran late del acido consumido en fabricación de fertilizantes, produce un acido relativamente diluido.
Proceso de contacto. produce un acido mas puro y concentrado
ESQUEMA DEL PROCESO DEL ACIDO SULFURICO.
 |
| http://www.100ciaquimica.net/images/temas/tema11/ima/sinh2so4.gif |
REACCION QUIMICA
Se realiza apartar del SO2 este se oxida a SO3 y luego se obtiene acido sulfúrico en reacción con el agua.
FACTORES QUE LO MODIFICAN
TEMPERATURA. Aumenta la energia cinetica de las moleculas o iones y por lo tanto consigue el movimiento de estos por lo cual aumenta la probabilidad del choque entre ellos.
SUPERFICIE. Una o todas las sustancias señalan en estado liquido, la velocidad de esta reacción depende de la superficie expuesta a esta reacción.
AGITACION y LUZ.
CONCENTRACION DE LOS REACTIVOS. A mayor concentración mayor velocidad de reacción.
CATALIZADORES: Sutancias que aceleran la velocidad de reacción sin sufrir ellas mismas cambios químicos.(Hidróxidos,2016)
LOS HIDROXIDOS COMO ANTIACIDOS
Los hidróxidos son compuestos ionices formados por un metal (catión) y un elemento del grupo hidróxido (OH-) (anión). Generalmente se producen por reacción química del agua con los óxidos básicos o por la reacción directa de un metal alcalino o alcalino térreo con el agua.
Son utilizados como antiácidos porque cuando entran en contacto con los ácidos producen una reacción de neutralización la cual calma la acidez estomacal.
ANTIACIDOS: Sustancias o productos basados en una composición alcalina (básica), la cual se utiliza para luchar contra la acidez de estomago producida por los ácidos que generan las glándulas parietales. Así, los antiácidos actúan haciendo que se alcalinice el medio estomacal, consiguiendo incrementar el valor de pH.
 |
| http://image.slidesharecdn.com/anticidos-130717055845-phpapp01/95/anticidos-7-638.jpg?cb=1374040769 |
Las sustancias antiácidas se encuentran formadas por bases de tipo débil, por lo cual trabajan esencialmente a traves de un mecanismo de reacciones que consisten en la neutralización del acido estomacal al entrar en contacto con este, para dar lugar a la formación de agua y sal.
A pesar de que la principal función que tiene un antiácido es la neutralización de la acidez en el estomago, rabien se hace posible que sirvan para despertar los sistemas defensivos de la mucosa, gracias a la estimulacion de la aparición de prostanglandinas. La industria farmacéutica busca disminuir los efectos secundarios derivados de la ingesta de antiácidos, pues en algunos casos producen estreñimiento, o el efecto contrario.
Existen diferentes tipos de antiácidos, los antiácidos no sistemáticos, y los sistemáticos.
-Los antiácidos no sistemáticos son aquellos que al reaccionar los antiácidos con el HCl presente en el estomago, dan lugar a la información de una sal que no es absorbida que no tiene ningún efecto adverso y su acción es mas larga y lenta. En este grupo de antiácidos se encuentran las sales de magnesio, aluminio y calcio.
-Los antiácidos sitematicos son aquellos que reaccionan con los ácidos presentes en el estomago, para que seguidamente un parte de la sal que se forma se absorba. Generalmente, este tipo de antiácidos son mas potentes y rápidos, pero su efecto es menos duradero. En este grupo podemos citar antiácidos como el hidróxido de magnesio o el hidrogeno carbonato de sodio.(Mendez,2014)
ELABORADO POR: GUADALUPE RAMIREZ
BLOQUE II: LA NOCION DEL MOL. UNA EXPRESION DE LA CANTIDAD DE SUSTANCIA
COMPOSICION CUANTITATIVA DE LOS ELEMENTOS
MOL: Es la unidad que mide la cantidad de sustancia en el sistema internacional.
se define como la cantidad de sustancia de un sistema que tiene tantas entidades elementales como átomos hay en 0.012kg de carbono.
1 MOl ES IGUAL AL NUMERO DE AVOGADRO QUE SE MUESTRA EN LA SIGUIENTE IMAGEN.
1 mol siempre contiene el mismo numero de partículas. Pero la masa de un mol es de diferente valor.
MASA FORMULA (UMA)
Se obtiene sumando los pesos atómicos de cada elemento presente en un compuesto.
`ìmagen¨¨¨¨¨
MASA MOLAR
(Se realiza lo mismo que en masa formula)
Es la masa en gramos de un mol de atomos, moleculas o particulas de una sustancia; se representa con las unidades de gramos sobre mol (grs/mol).
¨¨¨ïmagen¨¨¨¨
PROPORCION PORCENTUAL
Es la proporcion que hay de un elemento en un compuesto, se determina mediante:
Porcentaje del elemento ≠ (masa atomica) (indice) * 100 entre Masa molar
¨¨¨ïmagen¨¨¨¨
MASA MINIMA O EMPIRICA
Pasos:
1. Ver los elementos.
2. Realiza una fracción con el porcentaje entre la masa.
3. Tomar el valor menor de lo que te resulto en las divisiones anteriores.
4. Volver a hacer la fracción y poner el de menor valor en todos los denominadores.
5. Colocar el resultado en el numerador.
6. Al final debe ser el resultado entero -(si da con decimal, multiplica por un numero a todos hasta que te de entero)- .
¨¨`ïmagen¨¨¨
ESTEQUIOMETRIA-RELACION
MASA MOLAR
(Se realiza lo mismo que en masa formula)
Es la masa en gramos de un mol de atomos, moleculas o particulas de una sustancia; se representa con las unidades de gramos sobre mol (grs/mol).
¨¨¨ïmagen¨¨¨¨
PROPORCION PORCENTUAL
Es la proporcion que hay de un elemento en un compuesto, se determina mediante:
Porcentaje del elemento ≠ (masa atomica) (indice) * 100 entre Masa molar
¨¨¨ïmagen¨¨¨¨
MASA MINIMA O EMPIRICA
Pasos:
1. Ver los elementos.
2. Realiza una fracción con el porcentaje entre la masa.
3. Tomar el valor menor de lo que te resulto en las divisiones anteriores.
4. Volver a hacer la fracción y poner el de menor valor en todos los denominadores.
5. Colocar el resultado en el numerador.
6. Al final debe ser el resultado entero -(si da con decimal, multiplica por un numero a todos hasta que te de entero)- .
¨¨`ïmagen¨¨¨
ESTEQUIOMETRIA-RELACION
````imagen de ejemplo¨¨¨¨
BLOQUE III EL ESTADO GASEOSO
Componentes mayoritarios y minoritarios.
Mayoritarios: son aquellos que están en mayor proporción en el aire: nitrógeno (N2), oxígeno (O2), argón (Ar), vapor de agua (H2O) y dióxido de carbono (CO2).
Minoritarios: son todos los componentes restantes que aparecen en cantidades muy pequeñas, medidos en partes por millón.

Mayoritarios: son aquellos que están en mayor proporción en el aire: nitrógeno (N2), oxígeno (O2), argón (Ar), vapor de agua (H2O) y dióxido de carbono (CO2).
Minoritarios: son todos los componentes restantes que aparecen en cantidades muy pequeñas, medidos en partes por millón.
Composición media del aire seco de la homosfera.
-Nitrógeno (N2)
-Oxígeno (O2)
-Argón (Ar)
-Dióxido de carbono (CO2) -Otros: Neón (Ne), Helio (He), Criptón (Kr), Hidrógeno (H2), Xenón (Xe), metano (CH4), Ozono (O3), óxidos de
Nitrógeno (NOx), etc.
-Oxígeno (O2)
-Argón (Ar)
-Dióxido de carbono (CO2) -Otros: Neón (Ne), Helio (He), Criptón (Kr), Hidrógeno (H2), Xenón (Xe), metano (CH4), Ozono (O3), óxidos de
Nitrógeno (NOx), etc.
78,083%
20,945%
0,934%
0,035%
0,003%
0,003%
A esto habría que añadir el vapor de agua, que no se ha puesto porque varía mucho de unas
zonas (4%) a otras (1%).
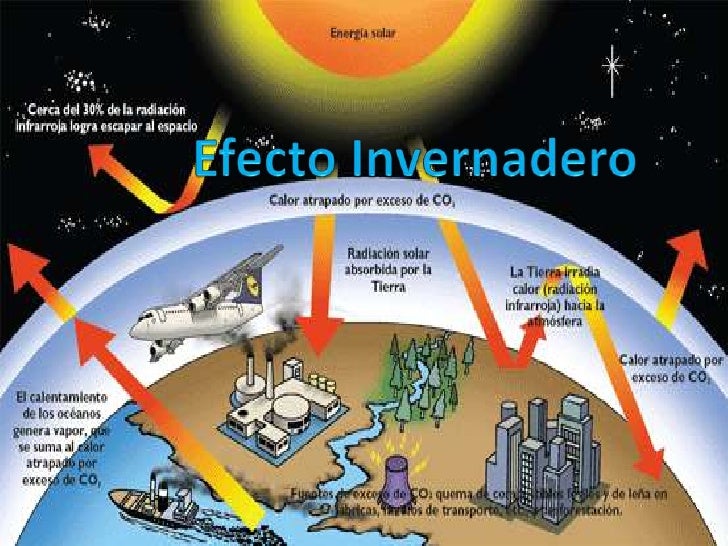
EL EFECTO INVERNADERO
El efecto invernadero es un fenómeno por el cual ciertos gases retienen parte de la energía emitida por el suelo tras haber sido calentado por la radiación solar. Se produce, por lo tanto, un efecto de calentamiento similar al que ocurre en un invernadero, con una elevación de la temperatura.
Aunque el efecto invernadero se produce por la acción de varios componentes de la atmósfera planetaria, el proceso de calentamiento ha sido acentuado en las últimas décadas por la acción del hombre, con la emisión de dióxido de carbono, metano y otros gases.
Así, además de esos dos citados gases también se encuentran el vapor de agua, el óxido de nitrógeno, el cloro fluoro carbono y el ozono. Elementos todos ellos que son naturales pero que, a raíz de la conocida Revolución Industrial en la que comenzó una intensa actividad en materia del uso de lo que son combustibles fósiles, han visto incrementar su presencia en la atmósfera y eso origina la situación de efecto invernadero que ahora nos ocupa. (Definicion.de, S.F)
 |
| http://image.slidesharecdn.com/efectoinvernadero-100623212053-phpapp02/95/efecto-invernadero-1-728.jpg?cb=1277328097 |
INVERSION TERMICA
Es un fenómeno que se presenta cuando en las noches despejadas el suelo ha perdido calor por radiación, las capas de aire cercanas a él se enfrían más rápido que las capas superiores de aire lo cual provoca que se genere un gradiente positivo de temperatura con la altitud (lo que es un fenómeno contrario al que se presenta normalmente, la temperatura de la troposfera disminuye con la altitud).
Esto provoca que la capa de aire caliente quede atrapada entre las 2 capas de aire frío sin poder circular, ya que la presencia de la capa de aire frío cerca del suelo le da gran estabilidad a la atmósfera porque prácticamente no hay convección térmica, ni fenómenos de transporte y difusión de gases y esto hace que disminuya la velocidad de mezclado vertical entre la región que hay entre las 2 capas frías de aire.
LEYES DE LOS GASES
De los tres estados de la materia, el estado gaseoso es muy significativo. Este estado se caracteriza porque sus moléculas están separadas a muy grandes distancias, y sus choques proporcionan energía cinética suficiente para que siga con su movimiento disperso. El gas va a depender de la presión, temperatura y cantidad de moles.
Estas son algunas características que se le atribuyen a los gases:
1. Se adaptan a la forma y el volumen del recipiente que los contiene. Al cambiar de recipiente puede comprimirse o expandirse.
2. Son comprimibles. Al existir espacios intermoleculares las moléculas se pueden acercar unas a otras reduciendo su volumen cuando aplicamos una presión.
3. Se expanden y combinan fácilmente.
4. Se dilatan. La energía cinética promedio de sus moléculas es directamente proporcional a la temperatura aplicada. (Marapacuto, 2011)
 |
| http://image.slidesharecdn.com/leygeneraldelosgases-110925175318-phpapp02/95/ley-general-de-los-gases-1-728.jpg?cb=1316973413 |
LEY DE BOYLE-MARRIOTE
Fue descubierta por Robert Boyle en 1662. La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante.
El volumen es inversamente proporcional a la presión:
1. Si la presión aumenta, el volumen disminuye.
2. Si la presión disminuye, el volumen aumenta. (Educaplus.org)
Fórmula de la ley: P1 * V1 = P2 * V2
Donde P, son presiones ; Donde V es volumen.
Ejemplo:
Una muestra de gas ocupa un volumen de 0.525 litros a 0.75 atmósferas. Si la temperatura se mantiene constante, ¿cuál será la nueva presión si el volumen aumenta a o.776 litros?
Datos
V1= 0.521 l
P1= 0.75 atm
V2= 0.776 l
P2= no se sabe el valor
Fórmula: P1 * V1= P2 * V2
DESPEJE: P2= P1 * V1 / V2
Sustitución: Resultado:
0.75 atm * 0.521 l / 0.776 l P2= 0.503 atm
 |
| http://img.webme.com/pic/q/quimicacolguanenta/Ley%20de%20combinada%20de%20los%20gases.png |
LEY O NÚMERO DE AVOGADRO
Amadeo Avogadro fue un físico italiano que a través de hipótesis sobre el número de moléculas existentes en muestras de gas, explicó cómo los gases se combinan, manteniendo una proporción simple entre ellos y aún concluye que el hidrógeno, oxígeno y nitrógeno son biatómicos, es decir: H2, O2 y N2.
El científico Avogadro apoyándose en los conocimientos de los gases en su época y los resultados de sus experimentos, formuló una hipótesis sobre el número de moléculas en un gas.
Conforme a las investigaciones su valor actual es de 6.022 * 1024moléculas.
Con respecto a su ley con los gases, dice lo siguiente:
“Volúmenes iguales de dos gases en las mismas condiciones de temperatura
y presión, poseen el mismo número de moléculas”.
El enunciado se expresa con la siguiente fórmula:
V1/ n1 = V2/n2
Donde V es el volumen; y donde “n” es el número de moles.
En esta ley la presión y temperaturas son constantes.
(González, 2010)
LEY GAY-LUSSAC
Joseph Louis Gay-Lussac (físico francés) que en 1802 observó lo siguiente:
“Todos los gases se expanden a una misma fracción de volumen para un mismo aumento en la temperatura”.
Esto reveló la existencia de un coeficiente de expansión térmica común.
Esta ley establece la relación entre la temperatura y presión de una gas cuando el volumen es constante.
El aumento de temperatura en un gas, hace que las moléculas choquen más rápido contra el recipiente y aumente la presión.
El volumen y moles son constantes.
La fórmula del enunciado queda expresada de la siguiente manera:
P1/T1 = P2/T2
Donde P es presión ; y donde T es temperatura.
(Leyes de los gases, 2010)
 |
| http://images.slideplayer.es/12/3890566/slides/slide_4.jpg |
LEY COMBINADA DE LOS GASES
Esta ley establece como enunciado:
“El volumen ocupado por una masa gaseosa, es inversamente porporcional a las presiones y directamente proporcional a las temperaturas absolutas que soportan”.
En esta ley se combinan la de ley de Boyle, Charles y Gay Lussac.
La fórmula se expresa así:
P1*V1/ T1 = P2 * V2 / T2
Donde P es presión; donde V es el volumen; donde T es temperatura.
(Los Gases)
LEY DE DALTON
La ley de Dalton dice lo siguiente:
“La presión total de una mezcla es igual a la suma de las presiones parciales que ejercen los gases de forma independientes”.
PT = P1 + P2 + P3 …
P1, P2, P3 = Son las presiones parciales de cada gas.
(Los Gases )
LEY DE LOS GASES IDEALES
Estos gases a obedecen a las leyes de Boyle, Gay-Lussac y de Charles.
La ecuación general para los gases ideales, hay que considerar una determinada cantidad de gas ideal confinado en un recipiente donde se puede variar la presión, volumen y la temperatura, pero manteniendo la masa constante, es decir, sin alterar el número de moles.
La fórmula para esta ley es la siguiente:
PV= n R T
Donde P es presión; donde V es volumen ; donde n es número de moles ; donde R es constante universal de los gases ; donde T es temperatura
La constante universal de los gases “R” = 0.082 lt atm
mol K
LEY DE CHARLES
A presión constante, el volumen que ocupa una muestra de gas es directamente proporcional a las temperaturas absolutas que soportan"
En el siguiente video podrás apreciar la comprobación de la ley, de forma experimental.
De igual forma, puedes visualizar en el proceso siguiente la comprobación de la misma ley, y a su vez la representación que se establece entre la temperatura y el volumen.
De acuerdo con el enunciado, la ley de Charles puede expresarse matemáticamente de la siguiente manera:
V1.T2 = V2.T1 (P=cte)
En donde:
V= Volumen.
T= Temperatura.
P= Presión, la cual es constante.
BLOQUE 4
EL PETROLEO Y SUS DERIVADOS
El petróleo es la fuente de energía más importante en la actualidad; además es materia prima en numerosos procesos de la industria química. El origen del petróleo es similar al del carbón . En ambos casos, se hallan en las rocas sedimentarias, pero el petróleo procede de la descomposición de materia orgánica (especialmente restos de animales u grandes masa de placton en un medio marino). Su explotación es un proceso costoso que sólo está al alcance de grandes empresas.
COMPOSICIÓN QUÍMICA
Todos los tipos de petróleo se componen de hidrocarburos, aunque también suelen contener unos pocos compuestos de azufre y de oxigeno; el contenido de azufre varia entre un 0,1 y un 5%. Dichos hidrocarburos pueden separarse por destilación fraccionada de la que se obtienen aceites ligeros (gasolina), vaselina, parafina, asfalto y aceites pesados.
El petróleo contiene elementos gaseosos, líquidos y sólidos. La consistencia del petróleo varía desde un líquido tan poco viscoso como la gasolina hasta un líquido tan espeso que apenas fluye. Por lo general, hay pequeñas cantidades de compuestos gaseosos disueltos en el líquido; cuando las cantidades de estos compuestos son mayores, el yacimiento de petróleo está asociado con un depósito de gas natural.
La composición elemental del petróleo normalmente varía entre estos intervalos:
Elemento
|
Peso %
|
Carbono
|
84-87
|
Hidrógeno
|
11-14
|
Azufre
|
0-2
|
Nitrógeno
|
0,2
|
HIDROCARBUROS
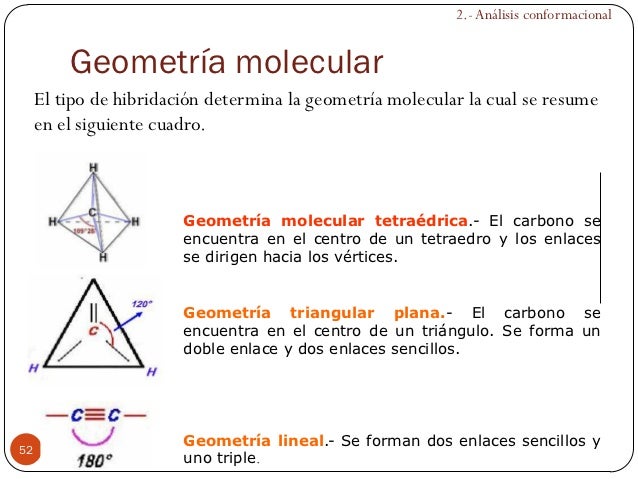
Los hidrocarburos son compuestos de carbono e hidrógeno que, atendiendo a la naturaleza de los enlaces, pueden clasificarse de la siguiente forma:
¦ Saturados ¦ Alcanos
¦ Alifáticos ¦
¦ ¦ ¦ Alquenos
¦ ¦ Insaturados ¦
Hidrocarburos ¦ ¦ Alquinos
¦
¦ Aromáticos
1.- Cadena más larga: metano, etano, propano, butano, pentano,...
2.- Las ramificaciones como radicales: metil(o), etil(o),...
3.- Se numera para obtener los números más bajos en las ramificaciones.
4.- Se escriben los radicales por orden alfabético y con los prefijos di-, tri-, ... si fuese necesario.
5.- Los hidrocarburos cíclicos anteponen el prefijo ciclo-
Propiedades físicas
CH4 + Cl2 ----> CH3Cl + HCl
1.- Seleccionar la cadena principal: mayor número de dobles enlaces y más larga. Sufijo -eno.
2.- Numerar para obtener números menores en los dobles enlaces.
Propiedades físicas
CH3-CH=CH-CH3 + XY ------> CH3-CHX-CHY-CH3
1.- Se consideran como dobles enlaces al elegir la cadena principal.
2.- Se numera dando preferencia a los dobles enlaces.
 |
| http://image.slidesharecdn.com/04-alcanos-121031022320-phpapp02/95/04-alcanos-52-638.jpg?cb=1351650648 |
 |
| http://images.slideplayer.es/1/21804/slides/slide_3.jpg |
Reglas para nombrar los Alcanos según IUPAC
| 1 | Se escoge como estructura principal la cadena de átomo de carbono más larga, la cual puede tener forma lineal, de L o de herradura. | |||||||||
| 2 | Se enumeran los átomos de carbono de la cadena principal, comenzando por el extremo más cercano al grupo o los grupos que están unidos a dicha cadena. | |||||||||
| 3 | Se indica la posición que ocupa cada grupo subyacente dentro de la cadena principal. En caso de que un mismo grupo aparezca más de una vez unido a la cadena principal se utilizan los prefijos Di, Tri, Tetra, para indicar la cantidad de veces que aparece repetido. | |||||||||
| 4 | Cuando aparecen grupos diferentes unidos a la cadena principal se colocan los nombres de los grupos en orden alfabético. | |||||||||
| 5 | Se nombra el compuesto con la terminación ano, anteponiendo el prefijo que indica el número de átomos de carbono de la cadena principal. EJEMPLOS:
|
Isomería cis-trans
La isomería cis-trans (o isomería geométrica) es un tipo de estereoisomería de los alquenos y cicloalcanos.
Se distingue entre el isómero cis, en el que los sustituyentes están en el mismo lado del doble enlace o en la misma
cara del cicloalcano, y el isómero trans, en el que están en el lado opuesto del doble enlace o en caras
opuestas del cicloalcano.
GRUPOS FUNCIONALES
Para facilitar el estudio de la química del carbono, los compuestos se agrupan en grupos funcionales. Estos grupos engloban compuestos con estructuras similares, y por lo tanto, propiedades físicas y químicas muy parecidas.
Los grupos funcionales son átomos o grupos de átomos unidos a cadenas de hidrocarburos alifáticas o aromáticas y es la zona de reactividad de las moléculas.
Las reglas de nomenclatura de la IUPAC para los compuestos con diferentes grupos funcionales son semejantes, sólo se tiene que tomar en consideración el o los grupos presentes en las moléculas para indicar cuál es el sustituyente de un grupo funcional.
Grupos funcionales
Tipo de compuesto
|
Fórmula
|
Grupo
funcional |
Estructura
|
Ejemplo
|
Alcano
|
R-CH2-CH2-R'
|
R-H
| ||
Alqueno
|
R-CH=CH-R'
|
Doble enlace
| ||
Alquino
|
R-C≡C-R'
|
Triple enlace
| ||
Aromático
|
Ar-R
|
Anillo
bencénico |  | |
Alcohol
|
R-OH
|
Grupo
Hidroxilo |
CH3-OH
| |
Éter
|
R-O-R'
|
Grupo
alcoxi |
CH3-O-CH3
| |
Aldehído
|
R-C(=O)H
|
Grupo
carbonilo |
CH3-CHO
| |
Cetona
|
R-C(=O)-R'
|
Grupo
carbonilo |
CH3-OC-CH3
| |
Ácido carboxílico
|
R-COOH
|
Grupo
carboxilo |
CH3-CH2-COOH
| |
Éster
|
R-COO-R'
|
Grupo
alcoxicarbonilo |
CH3-COO-CH3
| |
Amina
|
R-NR2
|
Grupo
amino | ||
Amida
|
R-C(=O)N(-R')-R"
|
Grupo
carboxamida | ||
Haluro
|
R-X
|
X = F, Cl, Br o I
|
R-X
|
CH3-CH2-Br
|
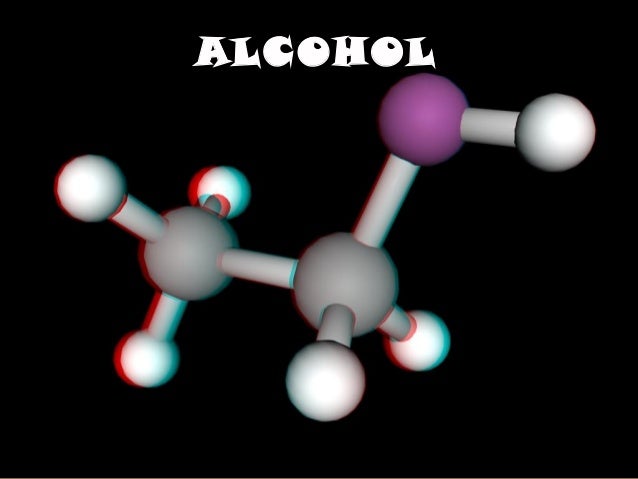
Alcoholes.
Los alcoholes son compuestos en los que un hidrógeno de un alcano es sustituido por un grupo hidroxilo (-OH). Pueden existir compuestos con dos, tres o más grupos de este tipo insertados en una cadena, siempre y cuando se encuentren en carbonos diferentes. No existen moléculas en las que esté insertado más de un hidroxilo, ya que son inestables.
Los alcoholes se clasifican en primarios, secundarios o terciarios, dependiendo de donde se encuentre insertado el –OH; en un carbono primario, secundario o terciario.
R, R’ y R’’ son radicales alquilo iguales o diferentes.
Nomenclatura.
- Se nombra la cadena más larga que contenga el grupo –OH y se sustituye la terminación odel alcano correspondiente por la terminación ol.
- Cuando existen sustituyentes se numera la cadena de tal forma que al grupo –OH le toque el número más bajo.
- Se nombran los sustituyentes con el número que les corresponda. Primero los halógenos y después los radicales alquilo.
- Cuando el –OH se une a un anillo del benceno, se utiliza fenol.
- Si existen dos o más grupos –OH en la molécula, se indica su ubicación con números separados por comas y la terminación diol para dos –OH y triol para tres.Propiedades físicas Y QUIMICASLa estructura de los alcoholes es parecida a la estructura del agua, en donde se ha sustituido un hidrógeno por un radical alquilo o arilo, por lo que tienen propiedades similares. La electronegatividad del oxígeno provoca la polarización del enlace O-H y del C-O, lo que produce la aparición de momentos dipolares y que sean más solubles en disolventes polares. Los tres primeros miembros de la serie son solubles en agua y a medida que aumenta el número de carbonos, la solubilidad disminuye. El fenol y el etilenglicol son solubles en agua.Los puntos de fusión y ebullición, con respecto a los alcanos son elevados, debido a la formación de puentes de hidrogeno. Estos enlaces se forman entre el oxígeno de una molécula y el hidrógeno de otra.Éteres.Los éteres también se consideran derivados del agua, donde los dos hidrógenos han sido sustituidospor radicales alquilo o arilo. Su fórmula general es R-O-R’ o Ar-O-Ar’.Nomenclatura.Los éteres más pequeños casi siempre se denominan por sus nombres comunes, los que se forman con los dos nombres de los sustituyentes en orden alfabéticos, seguidos de la palabra éter.En la nomenclatura sistemática (IUPAC), nombra un éter como un alcano con un sustituyente RO, en el que cambia la terminación il por oxi.Propiedades físicas.
La mayoría de los éteres son líquidos a temperatura ambiente, sólo es gas el metoximetano. Sus puntos de ebullición aumentan al aumentar el peso molecular. Los éteres que tienen de uno a cinco átomos de carbono, son solubles en agua y a medida que la longitud de la cadena aumenta su solubilidad disminuye. Son menos densos que el agua.Usos.
Son compuestos de gran estabilidad, muy usados como disolventes inertes por su baja reactividad. El éter sirve como medio de extracción de compuestos orgánicos solubles, como lípidos, aldehídos y alcaloides.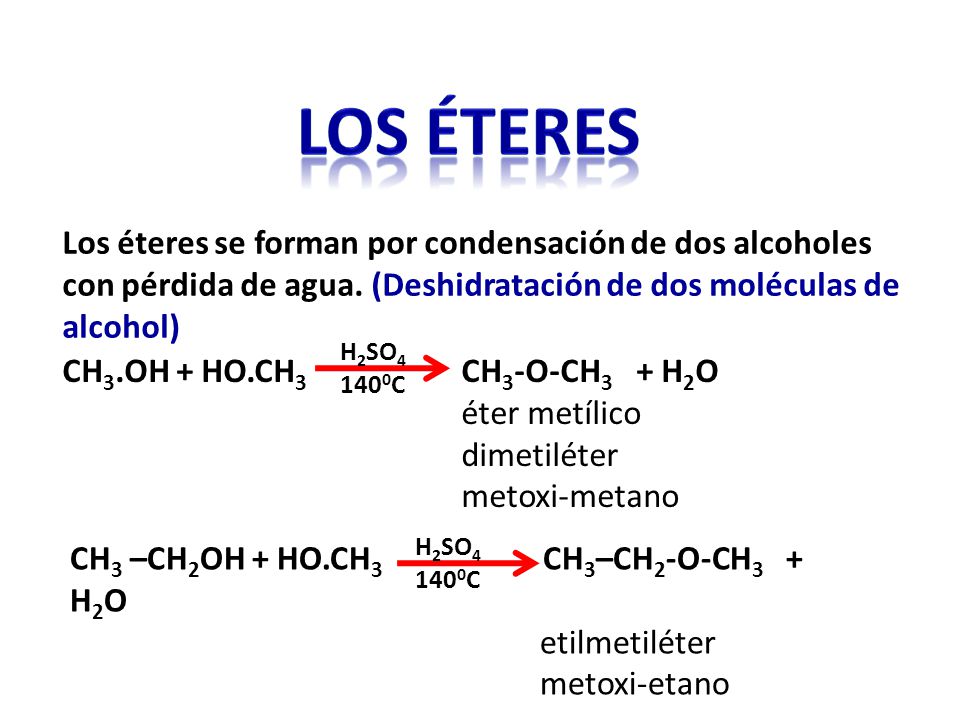
http://images.slideplayer.es/13/3993507/slides/slide_4.jpg Aminas.Las aminas se consideran compuestos derivados del amoniaco, en el que se sustituyen uno, dos o tresde los hidrógenos por radicales alquilo.
http://www.quimicayalgomas.com/wp-content/uploads/2011/10/aminas-primarias.png Las aminas al tener pares de electrones sin compartir, se comportan como bases de Bronsted Lowry al aceptar un protón de un ácido. Son bases ligeramente fuerte. Algunos compuestos biológicos de gran importancia son aminas, como los neurotransmisores y biorreguladores. Debido a su alto grado de actividad biológica muchas aminas se emplean como medicamentos.NOMENCLATURA:Regla 1. Las amidas se nombran como derivados de ácidos carboxílicos sustituyendo la terminación -oico del ácido por -amida.
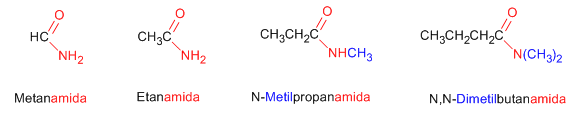
Regla 2. Las amidas son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos y nitrilos.
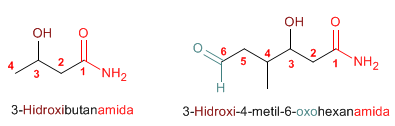 Regla 3. Las amidas actúan como sustituyentes cuando en la molécula hay grupos prioritarios, en este caso preceden el nombre de la cadena principal y se nombran como carbamoíl.......
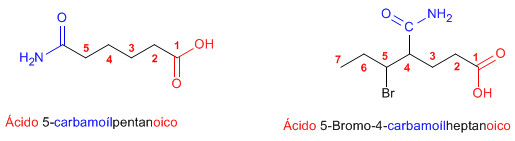
Regla 3. Las amidas actúan como sustituyentes cuando en la molécula hay grupos prioritarios, en este caso preceden el nombre de la cadena principal y se nombran como carbamoíl.......
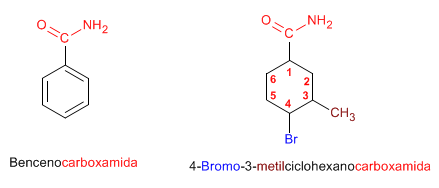
Regla 4. Cuando el grupo amida va unido a un ciclo, se nombra el ciclo como cadena principal y se emplea la terminación -carboxamida para nombrar la amida.
 En la nomenclatura de la IUPAC, la cadena principal es la que contiene mayor número de carbonos y se sustituye la terminación o por amina. La posición del grupo amino se indica con un número tomando en cuenta que le corresponda el menor. Los sustituyentes se designan con el número de su posición y se utiliza el prefijo N, para los sustituyentes del nitrógeno.Propiedades físicas.
En la nomenclatura de la IUPAC, la cadena principal es la que contiene mayor número de carbonos y se sustituye la terminación o por amina. La posición del grupo amino se indica con un número tomando en cuenta que le corresponda el menor. Los sustituyentes se designan con el número de su posición y se utiliza el prefijo N, para los sustituyentes del nitrógeno.Propiedades físicas.
Las aminas son compuestos polares, por lo que las de masa molecular baja, son solubles en agua y al comparar aminas con el mismo número de carbonos, las primarias son más solubles que las secundarias, y éstas a su vez, más que las terciarias.
Las aminas primarias y secundarias pueden formar puentes de hidrógeno. Las aminas terciarias no pueden formar puentes de hidrógeno, sin embargo pueden aceptar enlaces de hidrógeno con moléculas que tengan enlaces O-H o N-H. Como el nitrógeno es menos electronegativo que el oxígeno, el enlace N-H es menos polar que el enlace O-H. Por lo tanto, las aminas forman puentes de hidrógeno más débiles que los alcoholes de pesos moleculares semejantes.Usos.
Las aminas se utilizan como productos químicos intermedios, disolventes, aceleradores del caucho, catalizadores, emulsionantes, lubricantes sintéticos, inhibidores de la corrosión y para la fabricación de cosméticos, medicamentos, herbicidas, pesticidas y colorantes.Aldehídos y cetonas.
Los aldehídos y las cetonas son compuestos carbonílicos que poseen un grupo llamado carbonilo(C=O). En los aldehídos, el carbonilo está unido a un hidrógeno y a un grupo alquilo o arilo a excepción del más simple de ellos, el formaldehido, que se une a dos átomos de hidrógeno. Las cetonas están conformadas por dos radicales alquilo o arilo que se unen al carbonilo.
Existen muchos aldehídos y cetonas en la naturaleza, se presentan como fragancias y sabores naturales como la vainilla, el cinamaldehído de la canela, el carvacrol de la hierbabuena y el alcanfor. Los grupos carbonilo y sus derivados son los rasgos estructurales principales de los carbohidratos y aparecen en otros compuestos importantes como colorantes, vitaminas y hormonas.
Los aldehídos y las cetonas son similares en estructura y tienen propiedades parecidas, pero en cuanto a reactividad, los aldehídos son más reactivos que las cotonas.Nomenclatura.Aldehídos.La nomenclatura de la IUPAC para los aldehídos se obtiene al sustituir la terminación o de alcano correspondiente, por la terminación al. Se debe contar el número de carbonos incluyendo al carbonilo, al que le corresponde el número 1. La posición de éste se omite porque siempre va al principio o al final de la cadena.
Los sustituyentes se nombran indicando el número que les corresponde.Los nombres comunes se forman del nombre común del ácido carboxílico que le corresponde, quitando la palabra ácido, y la terminación ico se sustituye por aldehído.
http://image.slidesharecdn.com/exposicin-cetonas-150810053451-lva1-app6891/95/exposicin-aldehido-9-638.jpg?cb=1439184958 Cetonas.La nomenclatura sistemática de las cetonas se obtiene sustituyendo la terminación o del alcano por ona. En las cetonas de cadena abierta, se enumera la cadena más larga en donde se encuentra el grupo carbonilo y que le toque la numeración más baja, se indica con un número su posición. En las cetonas cíclicas, al átomo del carbonilo se le asigna el número 1. Si existen sustituyentes se numeran y se nombran.Los nombres comunes de las cetonas se obtienen nombrando los dos grupos alquilo o arilo que van unidos al grupo carbonilo y añadiendo la palabra cetona.
http://image.slidesharecdn.com/exposicin-cetonas-150810053451-lva1-app6891/95/exposicin-cetonas-9-638.jpg?cb=1439184958 Ácidos carboxílicos.
Los ácidos carboxílicos son compuestos que están ampliamente distribuidos en la naturaleza, los podemos encontrar por todos lados, como el ácido láctico de la leche agria y la degradación bacteriana de la sacarosa en la placa dental, el ácido cítrico y ascórbico en las frutas, el ácido fornico en la picadura de abejas y hormigas y el ácido acético en la fermentación de vinos.
En los ácidos carboxílicos, un grupo hidroxilo se une al grupo carbonilo, para formar al grupo carboxilo.Nomenclatura.
En la nomenclatura de la IUPAC, un ácido carboxílico se nombra sustituyendo la terminación odel nombre del alcano correspondiente en átomos de carbono, por la terminación oico y se le antepone la palabra ácido (ácido ____oico). En caso que haya sustituyentes, se numera la cadena más larga que contiene al carboxilo y a este carbono se le asigna el número 1; se nombran los sustituyentes en orden alfabético indicando su ubicación.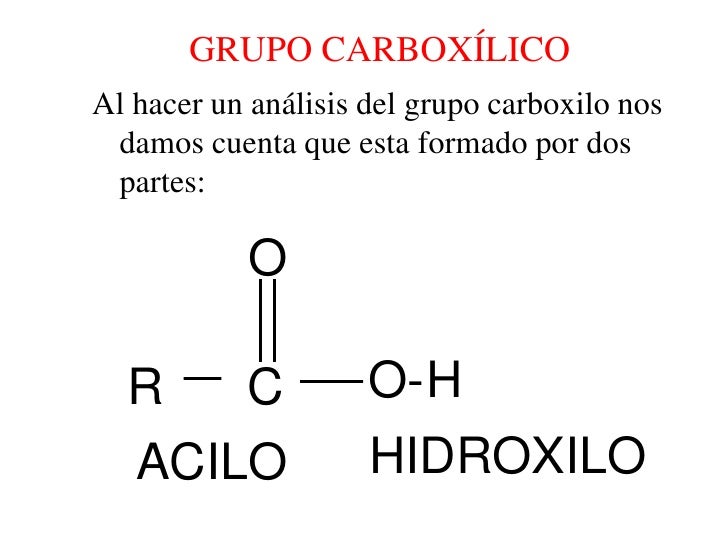
http://image.slidesharecdn.com/acidoscarboxilicos2012-120503004423-phpapp01/95/acidos-carboxilicos-2012-10-728.jpg?cb=1336005934 Muchos ácidos carboxílicos se conocen por sus nombres comunes que derivan de sus fuentes naturales, como el ácido fórmico que se extraía de las hormigas, que en latín es formica o el ácido butírico que se obtiene de la oxidación del butiraldehído presente en la mantequilla, que en latín es butyrum.En la nomenclatura común, la posición del sustituyente se designa mediante una letra griega minúscula, en donde el carbono del carbonilo no lleva designación. El carbono adyacente al del grupo carbonilo será el carbono α, el siguiente β y así sucesivamente.Derivados de ácidos carboxílicos. Ésteres y amidas.
Los derivados de los ácidos carboxílicos son compuestos en los que cambia el grupo hidroxilo (–OH) insertado en el grupo carbonilo, por el grupo –OR en los ésteres y el grupo –NH2en las amidas.Los ésteres y las amidas también se encuentran en la naturaleza y se pueden sintetizar en laboratorios para una gran cantidad de usos industriales. Las proteínas (polímeros), están enlazadas mediante grupos funcionales amida (enlace peptíco), y se han obtenido amidas sintéticas con propiedades similares a éstas. Por ejemplo, el Nylon es una poliamida sintética similar a la proteína de la tela de araña y todos los antibióticos del tipo de la penicilina y cefalosporina, son amidas con propiedades antimicrobianas mejoradas con respecto a los antibióticos naturales.Las grasas animales, los aceites vegetales y las ceras, como la cera de abeja y el esperma de ballena, son mezclas de ésteres. La aspirina es un éster. También, los sabores y los aromas de muchas frutas y flores son debidas a este tipo de compuestos. Industrialmente, se producen ésteres que son usados como saborizantes y esencias artificiales, para la fabricación de poliésteres y lubricantes.Nomenclatura de ésteres.Un ácido carboxílico reacciona con un alcohol para formar un éster, esta reacción se conoce como esterificación. Así, su nombre deriva del ácido carboxílico y del alcohol que lo forman. Primero se quita la palabra ácido y se cambia la terminación ico por ato, se agrega de seguido del nombre del alcohol al que se le cambia la terminación ol por ilo.
http://www.quimicayalgomas.com/wp-content/uploads/2011/10/Esteres-portada.jpg Nomenclatura de amidas.
Cuando reacciona un ácido carboxílico con una amina o con el amoniaco se obtienen las amidas.Para formar el nombre de las amidas, se quita la palabra ácido del que se originó y se cambia la terminación oico o ico, por amida. Si uno o dos sustituyentes están unidos al nitrógeno, se ponen primero los nombres ordenados alfabéticamente, anteponiéndoles la letra N que indica que están unidos al nitrógeno.Propiedades físicas.Los compuestos carbonílicos tienen puntos de ebullición que varían de manera aproximada de la siguiente forma:Amidas > ácidos carboxílicos >> ésteres ~ aldehídos ~ cetonasLas amidas tienen los puntos de ebullición más altos porque tienen fuertes interacciones dipolo-dipolo. Pueden formar enlaces de hidrógeno cuando el nitrógeno de una amida se une al hidrógeno de otra molécula. Los ésteres y las amidas son compuestos polares por lo que las de masa molecular baja, se disuelven en agua.
Los ácidos carboxílicos, también forman enlaces de hidrógeno entre sus moléculas, por lo que sus puntos de ebullición son altos. Los ácidos hasta con cuatro átomos de carbono son miscibles en agua y va decreciendo la solubilidad conforme aumenta la longitud de la cadena, de forma que los constituidos por más de diez átomos de carbono, son insolubles en agua.
Los ésteres al igual que las amidas son solubles en disolventes orgánicos como alcoholes, éteres, alcanos e hidrocarburos aromáticos. Los ésteres y amidas terciarias, se utilizan frecuentemente como disolventes en las reacciones orgánicas.ESTE ES EL FINAL DE NUESTRO BLOG, ESPERAMOS QUE LES HAYA SIDO DE MUCHA UTILIDAD.BIBLIOGRAFIA:
- Jose Martinez Pozos (2013)Reacción química 2016. Definicion de sitio web. definiciónderreaccionquimica.com
- Mariela Alvares Gasca. (2015)Reacciones químicas en un pastel.2016, definicion de sitio web. prez:/reposteriaquimica.com
- El proceso químico (2014) 20 minutos, Ago.2016 www.20minutos.es
- Josefina Amada Ramos(2013) Reacciones químicas. Proceso de respiración. definicion de sitio web. cubaeduca.quimica.cu
- El proceso químico del amor se produce en el cerebro(2016) 20 minutos Agos.2016 www.20minutos.es
- Factores que afectan la velocidad de reacción,(2016),Chemistrytutorials.org
- Angeles Mendez(2014)velocidad de reacción,2016 definicion de sitio web,quimicalaguia.com
· Angeles Mendez (2014)Antiácidas 2016, definicion de sitio web. http://quimica.laguia2000.com
- 1. Química estructura y dinamica James N Spencer, George M BOner, Lyman H Lykard Edit CECSA ,(2016)
Editorial: Pearson (Año: 2015, 8ª edición)
-
· Lluvia acida 2014,SEMARNAT,Sep2016,· Sandra Tellez (2014),Lluvia acida 2016, definicion de sitio web, http://sandratellezsiabatto.blogspot.mx
-
· Hidroxidos, 2016 Medlineplua, Sep2016 https://medlineplus.gov