BLOQUE II
EL LENGUAJE DE LA QUIMICA
APORTACIONES AL MODELO ATOMICO ACTUAL
Llamado "modelo orbital" o "cuántico undulatorio" u la dualidad onda-corpusculo: louis de broglie (1924) postula que el electron y toda particula material en movimiento tienen un comportamiento undulatorio. las propiedades ondulatorias y corpusculares de la materia se relacionan mediante.
DEMOCRITO Y LEUCIPO
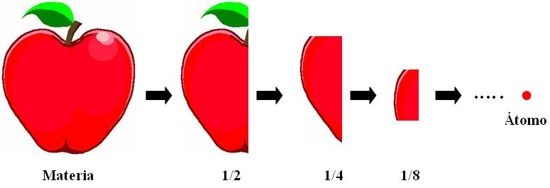
Para el año 400 ac, democrito y leucipo propusieron la primera teoría atómica llamada la "discontinuidad de la materia" esta constituido en que la materia se podia dividir indeterminadamente en partículas mas pequeñas hasta tener unas diminutas e indivisibles, a las que democrito llamo átomos, las cuales constituyen a la materia. así había átomos de agua, aire, rocas etc.
a su vez a democrito y leucipo de abodella se les atribuye la fundación del atomismo:
º los atomos son eternos, indivivisibles, homogeneos incomprensibles e invisibles.
º se diferencian en su forma y tamaño.
º las propiedades de la materia varian según el agrupamiento de los átomos. No apoyan sus postulados mediante experimentos, explica mediante razonamientos lógicos.
EMPEDOCLES.
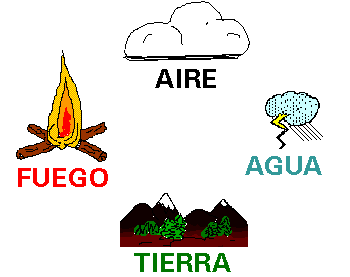
Decía que el atomo esta compuesto por 4 elementos los cuales eran:agua, fuego, tierra y aire.
Los sentimientos de amor y odio interferían en estos elementos.
ARISTOTELES
Pensaba lo contrario de democrito y aseguraba que las cosas estaban formadas por materia, las cuales no contenían espacios vacíos.
NIVEL SUBATOMICO
Corresponde al estado abiotico. esto quiere decir que la biosfera es la parte del planeta la cual esta habitada por los seres vivos y elementos químicos de este lugar. este tipo de niveles esta integrado por partículas subatomicas que forman elementos químicos (protones, neutrones, elementos).
POSTULADOS DE LA TEORIA ATOMICA DE DALTON.
1.La materia esta formada por atomos, pequeñas partículas indivisibles que no se pueden crear ni destruir.2.Todos los atomos de un elemento tienen la misma masa y propiedades.
3.Los atomos de diferentes elementos tienen distinta masa y propiedades.
4.Distintos atomos se combinan entre si en una relación numérica sencilla y dan lugar a un compuesto, siendo los átomos de un mismo compuesto iguales.
MODELO DE THOMPSON.
El nucleo del atomo era positivo y las cargas eran negativas.Lo llamaba, "Pastel de pasas".
EXPERIMENTO DE RUTHERFORD Y MODELO ATOMICO.
En el cual Rutherford estaba de acuerdo con Thompson.
MODELO ATOMICO DE BOHR.
El fisico danes Niels Bohr postula que los electrones giran a grandes velocidades alrededor del núcleo atómico.Los electrones se disponen en diversas orbitas circulares, las cuales determinan diferentes niveles de energía.
APORTACIONES O INVENTOS RELACIONADOS CON EL ESTUDIO DEL ATOMO Y SUS PARTICULAS.
Sommerfeld(1868–1951): En el modelo atómico de Bohr introdujo las órbitas elípticas de los electrones para explicar la estructura fina del espectro,resultando con ello un modelo perfeccionado. 1926
Schrodinger(1887–1961): Abandona la concepción de los electrones como esferas diminutas con carga que giran entorno al núcleo. Ademas describe a los electrones por medio de una función de (orbital), zona de probabilidad. 1925
J.J.Thompson(1856–1940: Descubrió el electron.
El modelo esta compuesto por electrones de carga negativa en un átomo positivo.llamado "Panqué de pasas". 1904
William Crookes(1832–1919): Descubrió los tubos de rayos catódicos o tubos al vacío. 1897
Millikan(1868–1953): Experimento de la gota de aceite,(determino el valor de la carga del electron. 1909
Goldstein(1850–1930): Rayos canales, trabajo con tubos de rayos catódicos y observo una luminiscencia a la cual le atribuyo, (protones).
Chadwick(1891–1974): Descubrimiento del neutron.
Becquerel(1852–1908): Descubrió la radioactividad, accidentalmente observo que el uranio revelaba las placas.
TEORIA ATOMICA ACTUAL
Concepto de estados estacionarios del elemento propuesto por Bohr:
1.Existencia del nucleo.
Los electrones giran en órbita circular alrededor del nucleo, bajo la influencia de las fuerzas de Coulum, sujetos a las leyes de la mecánica clásica.
2.Cuantizacion de la orbita.
El electron gira en orbita, donde el momento angular (L) del electron es un multiplo entero.
3.Estabilidad de la orbita.
Aunque el electron esta acelerado en su orbita. Su energia total es constante.
4.Radiacion electromagnética.
Un electron irradia energia si cambia en forma continua de una orbita de energia.
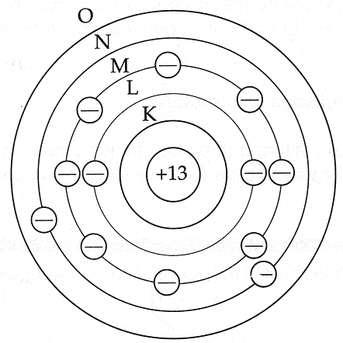
NUMERO ATOMICO.
Numero(z) es el numero de protones en el nucleo de cada atomo de un elemento.
z–numero atomico) igual al numero de electrones que es igual al numero de protones.
Elaborado por: Maria Del Carmen Samano Lule.
NUMERO DE MASA.
El numero de masa (A) es el total de protones y neutrones presentes en el nucleo del atomo de un elemento.
A es igual al numero de masa, igual numero de protones+ numero de neutrones.
A es igual al numero de masa, igual numero atomico+ numero de neutrones.
El numero de neutrones en un atomo es igual a la diferencia entre el numero de masa y el numero atómico:
Numero de neutrones es igual A–Z
IONES
CationSigno positivo, regala los electrones. Xm+
Anion
Signo negativo, atrae los electrones. Xm-
NUMEROS CUANTICOS.
Cada función de onda viene determinada por una serie de números cuánticos y solo son permitidas las funciones de onda de determinados conjuntos de numeros cuánticos que sirven también para definir el orbital atómico.Numero cuántico principal (n)
Expresa la mayor o menor probabilidad de encontrar al e- cerca del núcleo (a mayor n, el electron estaría mas tiempo alejado del núcleo). indica el numero de capa o nivel energético de la misma.
Numero cuántico secundario (I)
especifica el momento angular del electron en su movimiento al rededor del núcleo y determina la forma espacial del orbital. indica el numero de subniveles energéticos que puedan existir en un nivel dado por razones históricas, a cada valor de este número cuántico se le designa por una letra.
Numero cuántico magnetico (m)
representa la orientacion de la forma espacial de cada orbital según un eje obituario de referencia que viene dado por un campo magnético externo.
Los tres numeros cuánticos, antes descritos definen un orbital, su forma y su orientación, así como su energía.
NUMERO
|
SE REFIERE O SE RELACIONA CON
|
INDICA
|
n
|
El volumen o energía del orbital
|
Nivel
|
I
|
La forma de un orbital
|
Subnivel
|
m
|
La orientación de un orbital.
|
Numero de orbitales
|
s
|
La posibilidad de que un orbital acepte o no un electron.
|
Giro del electron.
|
n
|
I
|
m
|
Tipo de orbital
|
Numero de orbital
|
Numero de electron
|
1
|
0
|
0
|
1s
|
1
|
2
|
2
|
0
|
0
|
2s
|
1
|
2
|
2
|
1
|
-1 -0 +1
|
2p
|
3
|
6
|
3
|
0
|
0
|
3s
|
1
|
2
|
3
|
1
|
-1 0 +1
|
3p
|
3
|
6
|
3
|
2
|
-2 -1 0 +1 +2
|
3d
|
5
|
10
|
4
|
0
|
0
|
4s
|
1
|
2
|
4
|
1
|
-1 0 +1
|
4p
|
3
|
6
|
4
|
2
|
-2 -1 0 +1 +2
|
4d
|
5
|
10
|
ELABORADO POR: MARIA DEL CARMEN SAMANO LULE. 2"C", MATUTINO.
PRINCIPIO DE EXCLUSION DE PAULI.
"Dos electrones en un átomo no pueden tener idéntico numero cuántico"
Este es un principio general que no solo se aplica a los electrones.
PRINCIPIO DE EDIFICACION PROGRESIVA.
Los electrones deben acomodarse primero en los orbitales de menor energía o sea aquellos donde la suma de n+l sea menor, es decir:
Cada nuevo electron añadido a un átomo entrara en el electron disponible de menor energía.
REGLA DE MAXIMA MULTIPLICIDAD O REGLA DE HUNT.
"Dentro de un subnivel, los primeros electrones ocupan orbitales separados y tienen espines paralelos"
CONFIGURACION ELECTRONICA
ISOTOPOS.
Atomos del mismo elemento que tienen diferente numero de electrones.
ISOTOPOS RADIOACTIVOS
Al buscar mayor estabilidad, los átomos emiten espontáneamente radiaciones.
A estos isótopos se le conocen como radiactivos.
Isotopos: cobalto-60, yodo-131, carbono-11, plomo-212, carbono-14, carbono-11.
ALOTROPIA
Propiedad que poseen determinados elementos químicos de presentarse bajo estructuras moleculares diferentes, como el oxigeno atmosférico O2 y como ozono O3, o con características físicas distintas, como el fósforo que se presenta como fósforo rojo y blanco o el carbono que sirve para elaborar grafito y diamantes.
FULLERENO
- Son un conjunto de formas alotropicas del carbono, diferentes del diamante y del grafito.
- Como lubricante,(sus esferas facilitan el deslizamiento).
- Pueden tener aplicaciones ópticas,debido a que cambian sus propiedades ópticas bajo la acción de la luz ultravioleta.
¿CUAL ES LA VENTAJA DEL AZUFRE?
Esta misma propiedad hace que el azufre tenga un amplio campo de aplicación,
Se utiliza en la vulcanizaron de cauchos, en la manufacturacion de fertilizantes artificiales y en cierto tipo de cementos y aislantes eléctricos.
AZUFRE FUNDIDO
Se cristaliza de prismas en forma de aguja, que son casi incoloras.
posee una densidad de 1,96.
AZUFRE MONOCIINICO
También es llamado azufre prismático o azufre beta.
Viene siendo la modificación estable del elemento por encima de la temperatura de transición mientras que se encuentra por debajo del punto de fusión.
AZUFRE ROMBICO
Es conocido de la misma manera como azufre alfa.
Se halla de la transformación estable del elemento químico por debajo de los 95.5°C(240°F, el punto de transición) y la mayor parte de las otras formas se revierten a esta modificación si se les deja permanecer por debajo de esta temperatura.
El azufre rombico posee un color amarillo limon, insoluble en el agua, levemente soluble en alcohol etilico y muy soluble en disolfuro de carbono.
Elaborado Por: Guadalupe Mercado Navarrete.
EVOLUCION Y CLASIFICACION DE LOS ELEMENTOS EN LA TABLA PERIODICA.
CIENTIFICO
|
APORTACIONES A LA CLASIFICACION DE
ELEMENTOS
|
Joahn wolfagang
|
1817 mostro que el estroncio tenia una
masa atómica aproximadamente igual a la media aritmética de las masa
atomicas, mostro la existencia de los grupos: triadas.
|
John Alexander reina
|
1864 ordeno los elementos según sus
pesos atomicos. Encontró que las propiedades parecían repetirse en cada grupo
de 7 elementos. Anuncio como ley de las octavas, refiriéndose a la escala
musical.
|
Stanislao canizzaro
|
Encontró que el peso molecular (m) de
un compuesto gaseoso es aproximadamente el doble de su densidad relativa
respecto al hidrogeno y que el peso atomico de un elemento es el peso mas
pequeño del mismo contenido en un peso molecular de cualquiera de sus
compuestos.
|
Dimitri mendeleive
|
Las propiedades de los elementos dependen
de manera regular del cambio de peso atomico. Hace notar que la secuencia de
los elementos en la tabla esta en corcondancia con la valencia. Establece lo
que se conoce como ley periódica: las propiedades de los elementos son una función
periódica de sus pesos atomicos.
|
Lotar meyer
|
Se basaba en la serializacion de las
propiedades físicas de los elementos como el volum atomico, punto de fusión. Meyer
clasifico 55 elementos de los grupos principales y subgrupos si no que los
coloco intercalados.
|
"ORGANIZACION DE LOS ELEMENTOS EN LA TABLA PERIODICA"
- Se organizan en bloques (s,p,d,f)
- Para saber en que bloque se encuentran hay que utilizar la configuración electrónica.
- El periodo es la linea horizontal.
- El nivel mas grande de la configuración electrónica se utiliza para determinar el periodo.
- No es correcto decir: familia A o B.
- Para encontrar el grupo hay que fijarnos en que nivel de electrones termino la configuración electrónica.