BLOQUE II
EL LENGUAJE DE LA QUIMICA
APORTACIONES AL MODELO ATOMICO ACTUAL
Llamado "modelo orbital" o "cuántico undulatorio" u la dualidad onda-corpusculo: louis de broglie (1924) postula que el electron y toda particula material en movimiento tienen un comportamiento undulatorio. las propiedades ondulatorias y corpusculares de la materia se relacionan mediante.
DEMOCRITO Y LEUCIPO
Para el año 400 ac, democrito y leucipo propusieron la primera teoría atómica llamada la "discontinuidad de la materia" esta constituido en que la materia se podia dividir indeterminadamente en partículas mas pequeñas hasta tener unas diminutas e indivisibles, a las que democrito llamo átomos, las cuales constituyen a la materia. así había átomos de agua, aire, rocas etc.
a su vez a democrito y leucipo de abodella se les atribuye la fundación del atomismo:
º los atomos son eternos, indivivisibles, homogeneos incomprensibles e invisibles.
º se diferencian en su forma y tamaño.
º las propiedades de la materia varian según el agrupamiento de los átomos. No apoyan sus postulados mediante experimentos, explica mediante razonamientos lógicos.
EMPEDOCLES.
Decía que el atomo esta compuesto por 4 elementos los cuales eran:agua, fuego, tierra y aire.
Los sentimientos de amor y odio interferían en estos elementos.
ARISTOTELES
Pensaba lo contrario de democrito y aseguraba que las cosas estaban formadas por materia, las cuales no contenían espacios vacíos.
NIVEL SUBATOMICO
Corresponde al estado abiotico. esto quiere decir que la biosfera es la parte del planeta la cual esta habitada por los seres vivos y elementos químicos de este lugar. este tipo de niveles esta integrado por partículas subatomicas que forman elementos químicos (protones, neutrones, elementos).
POSTULADOS DE LA TEORIA ATOMICA DE DALTON.
1.La materia esta formada por atomos, pequeñas partículas indivisibles que no se pueden crear ni destruir.2.Todos los atomos de un elemento tienen la misma masa y propiedades.
3.Los atomos de diferentes elementos tienen distinta masa y propiedades.
4.Distintos atomos se combinan entre si en una relación numérica sencilla y dan lugar a un compuesto, siendo los átomos de un mismo compuesto iguales.
MODELO DE THOMPSON.
El nucleo del atomo era positivo y las cargas eran negativas.Lo llamaba, "Pastel de pasas".
EXPERIMENTO DE RUTHERFORD Y MODELO ATOMICO.
En el cual Rutherford estaba de acuerdo con Thompson.
MODELO ATOMICO DE BOHR.
El fisico danes Niels Bohr postula que los electrones giran a grandes velocidades alrededor del núcleo atómico.Los electrones se disponen en diversas orbitas circulares, las cuales determinan diferentes niveles de energía.
APORTACIONES O INVENTOS RELACIONADOS CON EL ESTUDIO DEL ATOMO Y SUS PARTICULAS.
Sommerfeld(1868–1951): En el modelo atómico de Bohr introdujo las órbitas elípticas de los electrones para explicar la estructura fina del espectro,resultando con ello un modelo perfeccionado. 1926
Schrodinger(1887–1961): Abandona la concepción de los electrones como esferas diminutas con carga que giran entorno al núcleo. Ademas describe a los electrones por medio de una función de (orbital), zona de probabilidad. 1925
J.J.Thompson(1856–1940: Descubrió el electron.
El modelo esta compuesto por electrones de carga negativa en un átomo positivo.llamado "Panqué de pasas". 1904
William Crookes(1832–1919): Descubrió los tubos de rayos catódicos o tubos al vacío. 1897
Millikan(1868–1953): Experimento de la gota de aceite,(determino el valor de la carga del electron. 1909
Goldstein(1850–1930): Rayos canales, trabajo con tubos de rayos catódicos y observo una luminiscencia a la cual le atribuyo, (protones).
Chadwick(1891–1974): Descubrimiento del neutron.
Becquerel(1852–1908): Descubrió la radioactividad, accidentalmente observo que el uranio revelaba las placas.
TEORIA ATOMICA ACTUAL
Concepto de estados estacionarios del elemento propuesto por Bohr:
1.Existencia del nucleo.
Los electrones giran en órbita circular alrededor del nucleo, bajo la influencia de las fuerzas de Coulum, sujetos a las leyes de la mecánica clásica.
2.Cuantizacion de la orbita.
El electron gira en orbita, donde el momento angular (L) del electron es un multiplo entero.
3.Estabilidad de la orbita.
Aunque el electron esta acelerado en su orbita. Su energia total es constante.
4.Radiacion electromagnética.
Un electron irradia energia si cambia en forma continua de una orbita de energia.
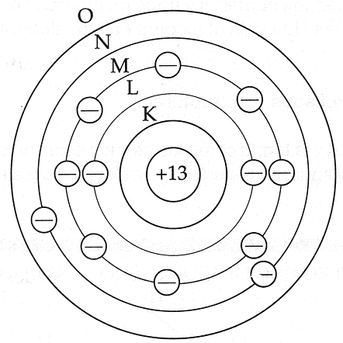
NUMERO ATOMICO.
Numero(z) es el numero de protones en el nucleo de cada atomo de un elemento.
z–numero atomico) igual al numero de electrones que es igual al numero de protones.
Elaborado por: Maria Del Carmen Samano Lule.
NUMERO DE MASA.
El numero de masa (A) es el total de protones y neutrones presentes en el nucleo del atomo de un elemento.
A es igual al numero de masa, igual numero de protones+ numero de neutrones.
A es igual al numero de masa, igual numero atomico+ numero de neutrones.
El numero de neutrones en un atomo es igual a la diferencia entre el numero de masa y el numero atómico:
Numero de neutrones es igual A–Z
IONES
CationSigno positivo, regala los electrones. Xm+
Anion
Signo negativo, atrae los electrones. Xm-
NUMEROS CUANTICOS.
Cada función de onda viene determinada por una serie de números cuánticos y solo son permitidas las funciones de onda de determinados conjuntos de numeros cuánticos que sirven también para definir el orbital atómico.Numero cuántico principal (n)
Expresa la mayor o menor probabilidad de encontrar al e- cerca del núcleo (a mayor n, el electron estaría mas tiempo alejado del núcleo). indica el numero de capa o nivel energético de la misma.
Numero cuántico secundario (I)
especifica el momento angular del electron en su movimiento al rededor del núcleo y determina la forma espacial del orbital. indica el numero de subniveles energéticos que puedan existir en un nivel dado por razones históricas, a cada valor de este número cuántico se le designa por una letra.
Numero cuántico magnetico (m)
representa la orientacion de la forma espacial de cada orbital según un eje obituario de referencia que viene dado por un campo magnético externo.
Los tres numeros cuánticos, antes descritos definen un orbital, su forma y su orientación, así como su energía.
NUMERO
|
SE REFIERE O SE RELACIONA CON
|
INDICA
|
n
|
El volumen o energía del orbital
|
Nivel
|
I
|
La forma de un orbital
|
Subnivel
|
m
|
La orientación de un orbital.
|
Numero de orbitales
|
s
|
La posibilidad de que un orbital acepte o no un electron.
|
Giro del electron.
|
n
|
I
|
m
|
Tipo de orbital
|
Numero de orbital
|
Numero de electron
|
1
|
0
|
0
|
1s
|
1
|
2
|
2
|
0
|
0
|
2s
|
1
|
2
|
2
|
1
|
-1 -0 +1
|
2p
|
3
|
6
|
3
|
0
|
0
|
3s
|
1
|
2
|
3
|
1
|
-1 0 +1
|
3p
|
3
|
6
|
3
|
2
|
-2 -1 0 +1 +2
|
3d
|
5
|
10
|
4
|
0
|
0
|
4s
|
1
|
2
|
4
|
1
|
-1 0 +1
|
4p
|
3
|
6
|
4
|
2
|
-2 -1 0 +1 +2
|
4d
|
5
|
10
|
ELABORADO POR: MARIA DEL CARMEN SAMANO LULE. 2"C", MATUTINO.
PRINCIPIO DE EXCLUSION DE PAULI.
"Dos electrones en un átomo no pueden tener idéntico numero cuántico"
Este es un principio general que no solo se aplica a los electrones.
PRINCIPIO DE EDIFICACION PROGRESIVA.
Los electrones deben acomodarse primero en los orbitales de menor energía o sea aquellos donde la suma de n+l sea menor, es decir:
Cada nuevo electron añadido a un átomo entrara en el electron disponible de menor energía.
REGLA DE MAXIMA MULTIPLICIDAD O REGLA DE HUNT.
"Dentro de un subnivel, los primeros electrones ocupan orbitales separados y tienen espines paralelos"
CONFIGURACION ELECTRONICA
ISOTOPOS.
Atomos del mismo elemento que tienen diferente numero de electrones.
ISOTOPOS RADIOACTIVOS
Al buscar mayor estabilidad, los átomos emiten espontáneamente radiaciones.
A estos isótopos se le conocen como radiactivos.
Isotopos: cobalto-60, yodo-131, carbono-11, plomo-212, carbono-14, carbono-11.
ALOTROPIA
Propiedad que poseen determinados elementos químicos de presentarse bajo estructuras moleculares diferentes, como el oxigeno atmosférico O2 y como ozono O3, o con características físicas distintas, como el fósforo que se presenta como fósforo rojo y blanco o el carbono que sirve para elaborar grafito y diamantes.
FULLERENO
- Son un conjunto de formas alotropicas del carbono, diferentes del diamante y del grafito.
- Como lubricante,(sus esferas facilitan el deslizamiento).
- Pueden tener aplicaciones ópticas,debido a que cambian sus propiedades ópticas bajo la acción de la luz ultravioleta.
¿CUAL ES LA VENTAJA DEL AZUFRE?
Esta misma propiedad hace que el azufre tenga un amplio campo de aplicación,
Se utiliza en la vulcanizaron de cauchos, en la manufacturacion de fertilizantes artificiales y en cierto tipo de cementos y aislantes eléctricos.
AZUFRE FUNDIDO
Se cristaliza de prismas en forma de aguja, que son casi incoloras.
posee una densidad de 1,96.
AZUFRE MONOCIINICO
También es llamado azufre prismático o azufre beta.
Viene siendo la modificación estable del elemento por encima de la temperatura de transición mientras que se encuentra por debajo del punto de fusión.
AZUFRE ROMBICO
Es conocido de la misma manera como azufre alfa.
Se halla de la transformación estable del elemento químico por debajo de los 95.5°C(240°F, el punto de transición) y la mayor parte de las otras formas se revierten a esta modificación si se les deja permanecer por debajo de esta temperatura.
El azufre rombico posee un color amarillo limon, insoluble en el agua, levemente soluble en alcohol etilico y muy soluble en disolfuro de carbono.
Elaborado Por: Guadalupe Mercado Navarrete.
EVOLUCION Y CLASIFICACION DE LOS ELEMENTOS EN LA TABLA PERIODICA.
CIENTIFICO
|
APORTACIONES A LA CLASIFICACION DE
ELEMENTOS
|
Joahn wolfagang
|
1817 mostro que el estroncio tenia una
masa atómica aproximadamente igual a la media aritmética de las masa
atomicas, mostro la existencia de los grupos: triadas.
|
John Alexander reina
|
1864 ordeno los elementos según sus
pesos atomicos. Encontró que las propiedades parecían repetirse en cada grupo
de 7 elementos. Anuncio como ley de las octavas, refiriéndose a la escala
musical.
|
Stanislao canizzaro
|
Encontró que el peso molecular (m) de
un compuesto gaseoso es aproximadamente el doble de su densidad relativa
respecto al hidrogeno y que el peso atomico de un elemento es el peso mas
pequeño del mismo contenido en un peso molecular de cualquiera de sus
compuestos.
|
Dimitri mendeleive
|
Las propiedades de los elementos dependen
de manera regular del cambio de peso atomico. Hace notar que la secuencia de
los elementos en la tabla esta en corcondancia con la valencia. Establece lo
que se conoce como ley periódica: las propiedades de los elementos son una función
periódica de sus pesos atomicos.
|
Lotar meyer
|
Se basaba en la serializacion de las
propiedades físicas de los elementos como el volum atomico, punto de fusión. Meyer
clasifico 55 elementos de los grupos principales y subgrupos si no que los
coloco intercalados.
|
"ORGANIZACION DE LOS ELEMENTOS EN LA TABLA PERIODICA"
- Se organizan en bloques (s,p,d,f)
- Para saber en que bloque se encuentran hay que utilizar la configuración electrónica.
- El periodo es la linea horizontal.
- El nivel mas grande de la configuración electrónica se utiliza para determinar el periodo.
- No es correcto decir: familia A o B.
- Para encontrar el grupo hay que fijarnos en que nivel de electrones termino la configuración electrónica.
CARACTERISTICAS DE LOS GRUPOS O FAMILIAS
Calcogenos: Tienen 6 electrones de valencia (ultima capa s2p4).
sus propiedades varían de no metálicas a metálicas en cierto grado conforme aumenta su Z.
El oxigeno y el azufre se utilizan ampliamente en la industria y el telurio y el selenio en la fabricación de semiconductores.
Grupo del Boro: Están situados en el grupo 13. Su nombre proviene de tierra, ya que el aluminio es el elemento metálico mas abundante en ella, llegando a un 75% tienen 3 electrones en su nivel energético mas externo. Su configuración electrónica es ns2np1.
Grupo del carbono: Poseen 4 electrones de valencia, el primer elemento del grupo da forma al diamante, al grafito y a los fullerenos.
Grupo del nitrógeno: Tienen 5 electrones de valencia (ultima capa s2p3), aparecen tanto las propiedades de metales como la de los no metales.
Halogenos: En estado natural se encuentran como moléculas diatomicas químicamente activas X2. Para llenar por completo por su ultimo nivel energético (s2p5) necesitan un electrón mas, por lo que tienen tendencia a formar un ion X1–. Su nombre significa formado de sal.
Metales alcalinos: No se encuentran libres en la naturaleza. Todos tienen un electrón en su ultimo nivel de energía.
Al reaccionar con el agua forman soluciones alcalinas o básicas de allí su nombre.
Metales alcalinos térreos: Poseen dos electrones en el ultimo nivel, que en condiciones apropiadas pueden ceder o compartir con otros elementos .
Metales de transición: Son utilizados en la construcción de diversos objetos de nuestra vida cotidiana.
Ejemplo: el cobre de los cables de electricidad.
Gases nobles: Poseen 8 electrones en el ultimo nivel que les da gran estabilidad, el mas ligero se utilizaba para inflar zeepelings.
METALES, NO METALES Y SEMI–METALES
- Se distinguen dos regiones de elementos, los metálicos a la izquierda de la tabla y cuyo comportamiento es el de perder electrones convirtiendose en cationes.
- El caracter metálico en la tabla aumenta de arriba hacia abajo en un grupo y de derecha a izquierda en un periodo.
PROPIEDADES GENERALES DE LOS METALES
- Poseen bajo potencia de ionización y alto peso especifico.
- Por regla general, en su ultimo nivel de energía tienen de 1 a 3 electrones.
- Buenos conductores de calor y electricidad.
- Se oxidan con la perdida de electrones.
- Los metales alcalinos son los mas activos.
- Ductiles y maleables, algunos son tenaces y otros blandos.
- Presentan aspecto y brillo metálico.
PROPIEDADES GENERALES DE LOS NO METALES
- Tienden a ganar electrones.
- Poseen alto potencial de ionización y bajo peso especifico.
- Por regla general en su ultimo nivel de energía tienen de 4 a 7 electrones.
- Se presentan en los tres estados de agregación.
- No poseen aspecto ni brillo metálico.
- Malos conductores de calor y electricidad.
- Se reducen por ganancia de electrones.
GRUPO (1) METALES ALCALINOS
- Se les debe guardar en atmósferas inertes o con bajo aceites.
- Los de mayor importancia son el sodio y el potasio.
- Con excepción del hidrogeno, todos blancos, brillantes, muy activos y se les encuentra combinados en forma de compuestos.
- Es el grupo mas heterogéneo de la tabla periódica.
- El nitrógeno esta presente en compuestos como proteínas fertilizantes y explosivos.
GRUPO VI (16) CALCOGENOS
- Los primeros 5 son No metales, el ultimo: Polonio es radioactivo.
- El oxigeno es un gas incoloro constituyente del agua, aire y tierra.
- El azufre es un solido amarillo y sus compuestos por lo general son tóxicos o corrosivos.
Son las propiedades que varían de forma gradual al movernos en un determinado sentido en el sistema periódico.
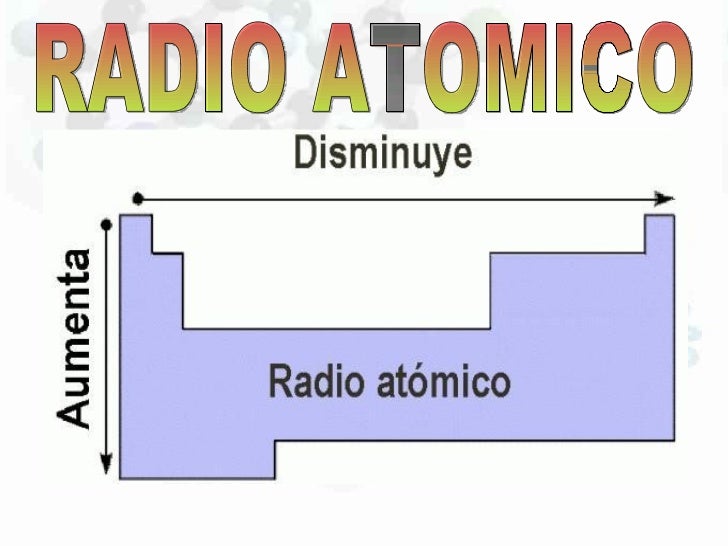
RADIO ATOMICO: El tamaño de un átomo no es variable si no que depende del entorno inmediato en el que se encuentre de su interacción de los átomos vecinos.
RADIO IONICO: Depende de la manera crucial del tamaño de los iones.
POTENCIAL DE IONIZACION: Es la energia necesaria para arrancar un electron de un atomo aislado en fase gaseosa en su estado fundamental y obtener un ion monopositivo gaseoso en un estado fundamental mas un electrón sin energia cinetica.
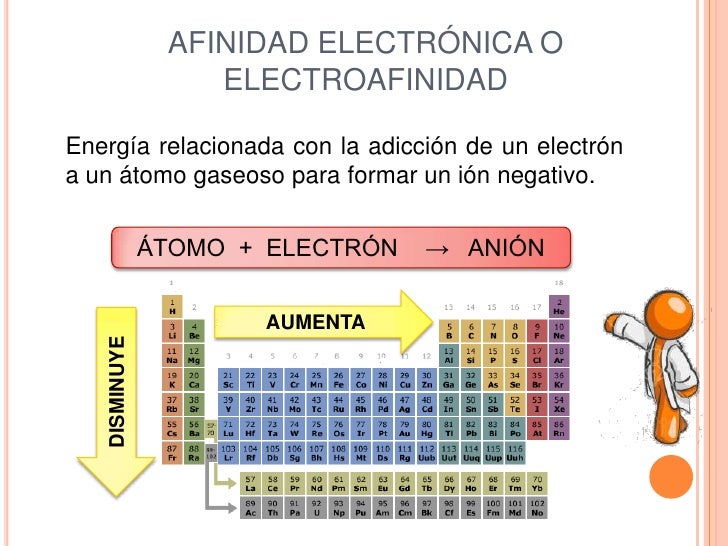
ELECTROAFINIDAD
ELECTRONEGATIVIDAD: Esta mide su tendencia al atraer hacia si electrones, cuando esta químicamente combinado con otro atomo.
REFERENCIAS:
Titulo: Química. Conceptos Y Aplicaciones Editorial: Mc Graw-hill Autor: John Phillips Categoría: Ciencias Naturales Y Exactas, Química Coleccion: Quimica Ano: 2007 Idioma: Español Isbn: 9701062906 Isbn13: 9789701062906
- Titulo: Estructura Atomica Y Enlace Quimico Editorial: Reverte Autor: Casabo J. Categoría: Química Tema: Quimica Idioma: Español Isbn: 8429171894 Isbn13: 9788429171891
- Título Química general Autor Ralph H. Petrucci Fecha publicación: 2003
Editorial: Prentice Hall 8ª Edición / 1280 págs. / Rústica / Castellano / Libro
ISBN13:9788420535333
- Titulo: Estructura Atomica Y Enlace Quimico Editorial: Reverte Autor: Casabo J. Categoría: Química Tema: Quimica Idioma: Español Isbn: 8429171894 Isbn13: 9788429171891
- Título Química general Autor Ralph H. Petrucci Fecha publicación: 2003
Editorial: Prentice Hall 8ª Edición / 1280 págs. / Rústica / Castellano / Libro
ISBN13:9788420535333
www.sites.google.com
www.es.slideshare.net
www.portaleducativo.net
www.enroquedeciencia.blogspot.mx
www.ape.lapampa.gov.ar
www.prezi.con
www.prezi.con
www.atomictheory3.blogspot.mx
www.es-puraquimica-weebly.com
www.quimicaindustrialoo2.blogspot.mx
www.cap7-teoriacuantica.blogspot.mx
www.quimicaitma2.blogspot.mx
www.slideplayer.es
www.teleformacion.edu.aytolacoruna.es
www.roskiciencia.wordpress.con
www.angélica ciencia tu alcance.blogspot. mx
www.es-puraquimica-weebly.com
www.quimicaindustrialoo2.blogspot.mx
www.cap7-teoriacuantica.blogspot.mx
www.quimicaitma2.blogspot.mx
www.slideplayer.es
www.teleformacion.edu.aytolacoruna.es
www.roskiciencia.wordpress.con
www.angélica ciencia tu alcance.blogspot. mx
Elaborado por: Miriam Mendoza Cabrera.
BLOQUE III
'ENLACES QUIMICOS Y INTERACCIONES MOLECULARES'
Cuando los átomos se unen para formar moléculas hay un interesante cambio de e- de valencia, esto es, de los e- cae una capa más externa de cada átomo. Esta unión es la más estable y se logra porque los átomos ganan, pierden o comparten e- y la atracción resultante entre los átomos participantes es el enlace químico.
 |
| http://image.slidesharecdn.com/enlacequmico-130523161143-phpapp02/95/enlace-qumico-1-638.jpg?cb=1369325590 |
ENLACES QUÍMICOS
•Interatómicos ( iónico, covalente y metálico).
•Intermoleculares (puente de hidrógeno y vanderwaals)
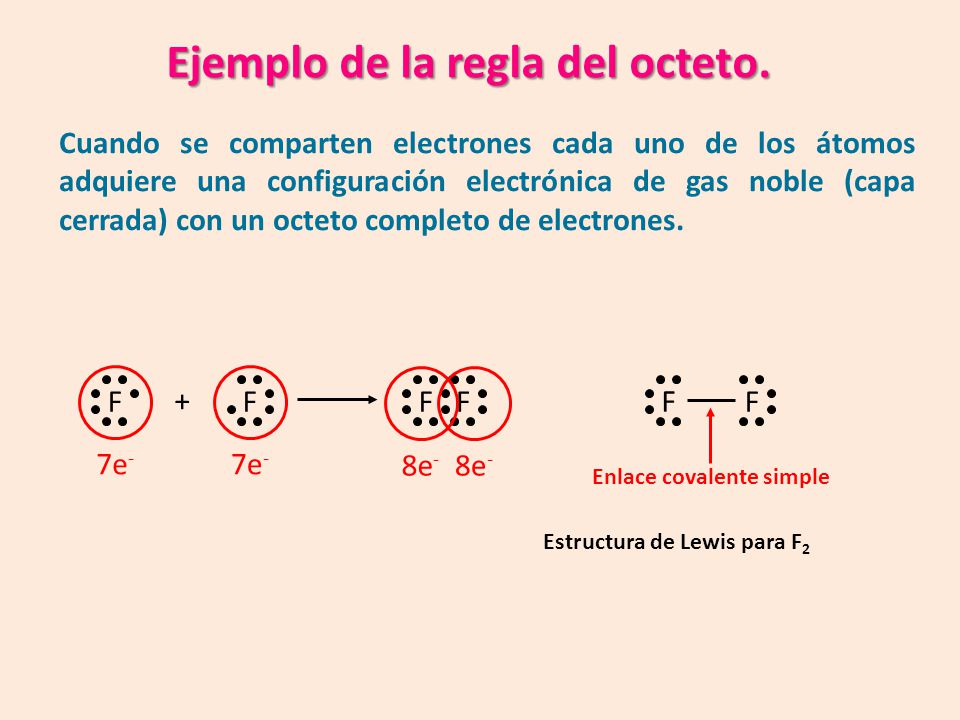
REGLA DEL OCTETO
La tendencia de los átomos es completar sus últimos niveles de energía con una cantidad de e- tal que adquieran la configuración semejante a un gas noble.
Como la configuración es S2P6 es un total de 8e-, los otros elementos ganaran o e- hasta quedar con esa cantidad en su capa externa:
•El metal pierde de 1 a 3 e- formando un catión.
•No metal gana 1 a 3 e- formando un anión.
•Los átomos (usualmente dos no metales), comparten e- con otros átomos alcanzando el numero del gas noble.
-Todos alcanzan el número del gas noble (8).
•La regla tiene limitaciones, puesto que, elementos ya compuestos covalentes no la siguen (boro y berilio).
•Se presenta también en algunas moléculas donde el átomo central presenta más de 8e- a su alrededor.
 |
| http://images.slideplayer.es/4/1515193/slides/slide_8.jpg |
ENLACE IONICO
Se produce cuando los atomos de elementos metalicos, se encuenran con los no metales. En este caso los atomos del metal ceden e- a los no metalicos transformandose en iones. Al formarse iones de carga opuesta estos se atraen por fuerzas electricas intensas, quedando fuertemente unidos. Tambien es conocido como "salino o electrocovalente", siendo arriba de (1.8), con metales de baja electronegatividad y no metales de alta electronegatividad, va desde 1.8 hasta 3.3.
 |
| http://image.slidesharecdn.com/6qumica4to-unidad2-enlacequmico |
PROPIEDADES DE UN ENLACE IONICO:
- Tienen puntos de fusion y ebullición elevados.
- Fundidos o en disolucion acuosa son buenos conductores de la corriente electrica, es decir, liquidos o disueltos en agua conducen corriente electrica.
- Son solubles en disolventes polares y agua.
- En solucion son quimicamente activos.
- La forma del cristal es geometrica (cubica, sombica, hexagonal). No se forman verdaderas moleculas sino redes cristalinas.
- Son solidos a temperatura ambiente, en este estado no conducen la corriente eléctrica.
ENLACE COVALENTE:
Es la union que se produce de dos o mas e- de su capa externa (de dos no metales) para formar una molecula estable. Durante este proceso dos tomos se han unido para formar una molécula.
Se divide en dos:
Polar: Uno de los atomos tiene mayor fuerza de atraccion de e- hacia su nucleo, originando una molecula con parte negativa y positiva (dipolo). Se producen cuando el enlace se realiza entre dos atomos diferentes; su grado de polaridad depemde de la fuerza de atraccion que atrae los atomos a su nucleo (electronegatividad), va desde 0.5 hasta 1.7.
Propiedades:.
 |
| http://image.slidesharecdn.com/presentacinenlacequimico-110803171821-phpapp01/95/presentacin-enlace-quimico-13-728.jpg?cb=1312391965 |
ENLACE COVALENTE COORDINADO:
O dativo se forma cuando dos atomos comparten un par de e-, pero solo uno de los atomos es quien los aporta (no metalico). Para que se presente se requiere que el atomo dador tenga un par de e- libres en un orbital exterior y el atomo aceptor tenga capacidad para recibir el par en su ultima capa de valencia. La idea es hacer un modelo que cumpla la regla del octeto.
ENLACE METALICO
Los metales forman unas redes metálicas compactas; es decir, con elevado índice de coordinación, por lo que suelen tener altas densidades. Las redes suelen ser hexagonales y cúbicas.
CARACTERISTICAS QUE SE DERIVAN DEL ENLACE METALICO:
- Son buenos conductores de electricidad y del calor.
- Presentan brillo característico.
- Aexcepcion del mercurio, los metales puros son solidos a temperatura ambiente. No obstante, sus puntos de fusión son muy variables, aunque generalmente altos.
TEORIA DE BANDAS
Es el tipo de enlace que se produce cuando se combinan entre sí los elementos metálicos; es decir, elementos de electronegatividades bajas y que se diferencien poco.
Los metales forman unas redes metálicas compactas; es decir, con elevado índice de coordinación, por lo que suelen tener altas densidades. Las redes suelen ser hexagonales y cúbicas.
TEORIA DEL MAR DE ELECTRONES.
Los elementos con un enlace metálico están compartiendo un gran número de electrones de valencia, formando un mar de electrones rodeando un enrejado gigante de cationes. Los metales tienen puntos de fusión más altos por lo que se deduce que hay enlaces más fuertes entre los distintos átomos. La vinculación metálica es no polar, apenas hay (para los metales elementales puros) o muy poco (para las aleaciones) diferencia de electronegatividad entre los átomos que participan en la interacción de la vinculación, y los electrones implicados en que es la interacción a través de la estructura cristalina del metal. El enlace metálico explica muchas características físicas de metales, tales como fuerza, maleabilidad, ductilidad, conducción del calor y de la electricidad, y lustre. La vinculación metálica es la atracción electrostática entre los átomos del metal o los iones y electrones deslocalizados. Esta es la razón por la cual se explica un deslizamiento de capas, dando por resultado su característica maleabilidad y ductilidad. Los átomos del metal tienen por lo menos un electrón de la valencia, no comparten estos electrones con los átomos vecinos, ni pierden electrones para formar los iones. En lugar los niveles de energía externos de los átomos del metal se traslapan. Son como enlaces covalentes.
FUERZAS INTERMOLECULARES
Las fuerzas intermoleculares se definen como el conjunto de fuerzas atractivas y repulsivas que se producen entre las moléculas como consecuencia de la presencia o ausencia de electrones.
Cuando dos o más átomos se unen mediante un enlace químico forman una molécula, los electrones que conforman la nueva molécula recorren y se concentran en la zona del átomo con mayor electronegatividad, definimos la electronegatividad como la propiedad que tienen los átomos en atraer electrones. La concentración de electrones en una zona específica de la molécula crea una carga negativa, mientras que la ausencia de los electrones crea una carga positiva.
Fuerzas Van Der Walls
El término "fuerzas de van der Waals" engloba colectivamente a las fuerzas de atracción entre las moléculas. Son fuerzas de atracción débiles que se establecen entre moléculas eléctricamente neutras (tanto polares como no polares), pero son muy numerosas y desempeñan un papel fundamental en multitud de procesos biológicos.
Las fuerzas de van der Waals incluyen:
ELABORADO POR: MIRIAM MENDOZA CABRERA.
-Fuerzas dipolo-dipolo
Una molécula es un dipolo cuando existe una distribución asimétrica de los electrones debido a que la molécula está formada por átomos de distinta electronegatividad. Como consecuencia de ello, los electrones se encuentran preferentemente en las proximidades del átomo más electronegativo. Se crean así dos regiones (o polos) en la molécula, una con carga parcial negativa y otra con carga parcial positiva,
Cuando dos moléculas polares (dipolos) se aproximan, se produce una atracción entre el polo positivo de una de ellas y el negativo de la otra. Esta fuerza de atracción entre dos dipolos es tanto más intensa cuanto mayor es la polarización de dichas moléculas polares o, dicho de otra forma, cuanto mayor sea la diferencia de electronegatividad entre los átomos enlazados.
Los enlaces serán tanto más polares cuanto mayor sea la diferencia de electronegatividad entre los átomos enlazados .
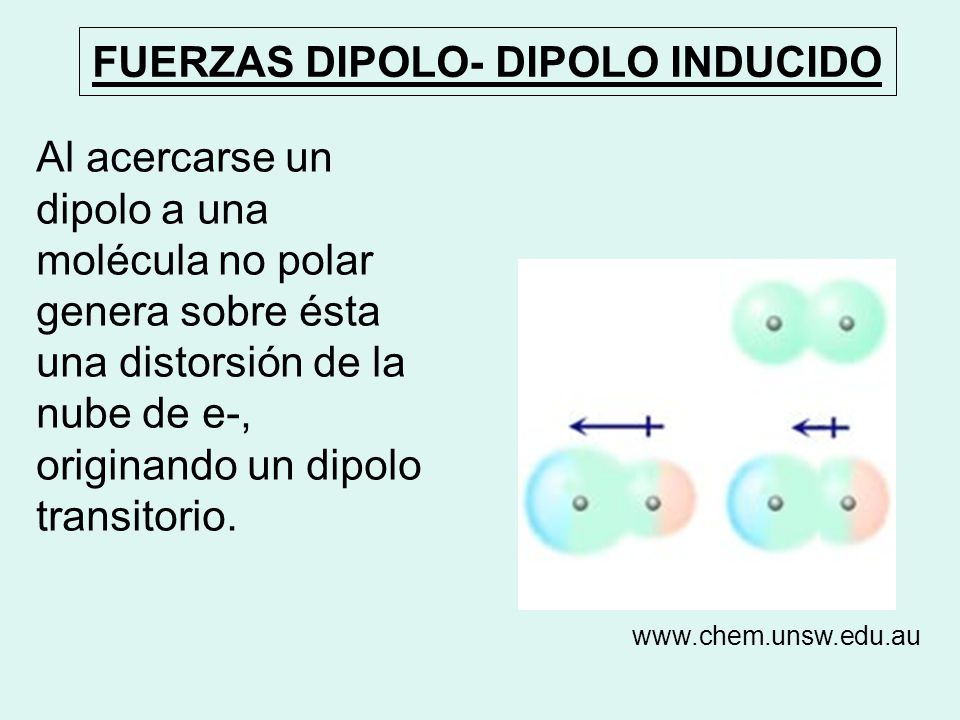
Dipolo-dipolo Inducido
 http://images.slideplayer.es/11/3139742/slides/slide_10.jpg |
Tienen lugar entre una molécula polar y una molécula apolar. En este caso, la carga de una molécula polar provoca una distorsión en la nube electrónica de la molécula apolar y la convierte, de modo transitorio, en un dipolo. En este momento se establece una fuerza de atracción entre las moléculas.
Gracias a esta interacción, gases apolares como el O2, el N2 o el CO2 se pueden disolver en agua.
-Fuerza de dispersion de London
fuerzas de tipo intermolecular. Dichas fuerzas tienen lugar entre moléculas de tipo no polar, donde pueden encontrarse dipolos.
Cuando se representan los orbitales de átomos y moléculas, la distribución de los electrones, es decir, la densidad electrónica, es el valor promediado en el tiempo. Lo que da origen a la atracción entre moléculas vecinas son las oscilaciones respecto a dicho valor promediado en el tiempo. Los átomos de los gases nobles nos proporcionan el ejemplo más sencillo. En promedio, la densidad electrónica debería ser esféricamente simétrica alrededor del núcleo atómico. Sin embargo, la gran parte del tiempo, los electrones tienen una distribución asimétrica; en consecuencia de esto, una parte del átomo tiene una densidad electrónica mayor y en otra la densidad electrónica es menor.
Puente de hidrogeno
constituyen un caso especial de interacción dipolo-dipolo (Figura de la derecha). Se producen cuando un átomo de hidrógeno está unido covalentemente a un elemento que sea:
muy electronegativo y con dobletes electrónicos sin compartir
de muy pequeño tamaño y capaz, por tanto, de aproximarse al núcleo del hidrógeno
Estas condiciones se cumplen en el caso de los átomos de F, O y N.
El enlace que forman con el hidrógeno es muy polar y el átomo de hidrógeno es un centro de cargas positivas que será atraído hacia los pares de electrones sin compartir de los átomos electronegativos de otras moléculas Se trata de un enlace débil (entre 2 y 10 Kcal/mol). Sin embargo, como son muy abundantes, su contribución a la cohesión entre biomoléculas es grande.
La distancia entre los átomos electronegativos unidos mediante un puente de hidrógeno suele ser de unos 3 Å. El hidrógeno se sitúa a 1Å del átomo al que está covalentemente unido y a 2 Å del que cede sus e- no apareados
 |
| http://www.100ciaquimica.net/images/temas/tema4/ima/enpuenH.gif |
4 BLOQUE
COMPUESTOS QUIMICOS:Por su naturaleza: Compuestos orgánicos.
Compuestos inorgánicos.
COMPUESTOS ORGANICOS:
De ACUERDO A SU GRUPO FUNCIONAL:
- Oxidos básicos u Oxidos metálicos.
- Oxidos ácidos u óxidos no metálicos o anhídridos.
- Hidróxidos.
- Sales.
- Acidos: Hidracidos, Oxiacidos.
- Peróxidos.
- Hidruros.
IONES MONOATOMICOS Y POLIATOMICOS:
Un ión monoatómico es una especie química, ya sea un átomo o molécula cargada eléctricamente, debido a que ha ganado o perdido electrones como consecuencia de una reacción química.
Los iones con carga negativa producidos por la ganancia de electrones reciben el nombre de aniones, y los que poseen carga positiva debido a la pérdida de electrones reciben el nombre de cationes.
Un ión monoatómico contiene solamente un átomo.
Un ión poliatómico contiene más de un átomo.
CONSTRUCCION DE FORMULAS DE LOS COMPUESTOS QUIMICOS
ESTADO DE OXIDACION
Estado de oxidación: tiene signo porque se considera a las uniones como iónicas por lo tanto es positivo si el átomo pierde electrones o los comparte con un átomo más electronegativo. Es negativo si el átomo gana electrones. Los metales por lo tanto tienen números de oxidación positivos porque tienden a ceder electrones. Los no metales tienen número de oxidación negativos.
EN GENERAL DEBEMOS RECORDAR QUE:
En general debemos recordar que:
- Los elementos en su estado natural tienen un número de oxidación de cero.
- Los metales en su forma iónica tienen un número de oxidación positiva.
- Los iones de metales alcalinos tienen un número de oxidación de +1
- Los iones de los metales alcalinotérreos tienen un número de oxidación de +2
- En un compuesto la suma algebraica de los números de oxidación debe ser de cero
- El oxígeno trabaja con -2
ELABORADO POR: MARIA DEL CARMEN SAMANO LULE.
OXIDOS METALICOS
Metal+O
Los óxidos metálicos, también conocidos como óxidos básicos, están formados por un metal + oxígeno. El oxígeno trabaja con su Valencia 2-.
Nomenclatura:
Stock
Se coloca la palabra "óxido" y después el nombre del no metal, se debe poder el número de oxidación en romano.
Ejemplo:
Ni2O3: óxido de níquel (III)
Si el metal tiene solo un número de oxidación, no se pone el numero en romano al final.
Ejemplo:
HgO: óxido de mercurio.
OXIDO NO METALICO
No Metal +O
Es la unión de un no metal + oxígeno, en la que éste último trabaja con su numero de oxidación 2- . Se encuentra principalmente en los gases de efecto invernadero.
Nomenclatura:
Estequiométrica
Consiste en anteponer a la palabra “óxido” un prefijo que nos indique el número de oxígenos seguida de “de” y el nombre del no metal con un prefijo que nos indique el número de átomos de ese no metal.
USOS EN LA VIDA COTIDIANA DE LOS OXIDOS DE LOS NO METALES:
COMO NOMBRAR ANHIDRIDOS
No Metal +O
Son compuestos formados por un no metal y oxígeno, también se les llamas óxidos no metálicos u óxidos ácidos.
COMO SE FORMAN Y USOS DE LOS HIDROXIDOS
Los hidróxidos son compuestos formados por un catión y un anión, los cuales son un metal y un elemento perteneciente al grupo hidróxido respectivamente.
Su nomenclatura es igual a la de los compuestos binarios. Por lo tanto los hidróxidos se nombran de la siguiente forma:
-HIDRÓXIDO mas NOMBRE DEL METAL más ESTADO DE OXIDACIÓN el cual se representa con número romanos.
HIDRACIDOS: USOS, COMO SE FORMAN Y NOMBRAN
H + No Metal
También se les conoce como ávidos hidrácidos.Son combinaciones binarias entre hidrógeno y los halógenos (menos el At) y con los anfígenos (menos el O).
Nomenclatura:
Tradicional
Se coloca la palabra "ácido" seguida del nombre del no metal más el sufijo "hídrico".
Ejemplos:
H2S: ácido sulfhídrico
HBr: ácido bromhídrico.
 |
| http://image.slidesharecdn.com/hidracidosoxiacidos-150805201117-lva1-app6891/95/hidracidos-oxiacidos-6-638.jpg?cb=1438805741 |
ACIDOS OXIGENADOS (OXIACIDOS)
Óxido no metálico + H2 O
El ácido oxigenado, también conocido como oxiácido, está formado por un óxido no metálico u óxido básico más agua.
Nomenclatura:
Se coloca la palabra "ácido" más el nombre del no metal con la terminación "ico"
O también se puede usar el nombre específico.
 |
| http://image.slidesharecdn.com/oxiacidos-150805201204-lva1-app6891/95/oxiacidos-4-638.jpg?cb=1438805827 |
SALES BINARIAS O HALOIDEA
Metal + Radical Simple -----> Sal Binaria
Para dar el nombre a las sales se escribe primero el nombre del radical simple, seguido por el nombre del metal, si éste tiene más de una valencia se especifica al igual que en los óxidos e hidróxidos. Utilizan el sistema Stocke. A continuación se puede ver la tabla con los símbolos y números de oxidación de los radicales simples:
HIDRUROS:
Metal + H
Es la combinación de un metal más hidrógeno, pero en este caso el hidrógeno trabaja con su Valencia 1-.
Nomenclatura:
Los hidratos se pueden formar con variadas nomenclaturas, en la tabla de abajo se muestran los tipos para que quede más claro.
PEROXIDOS:
X2(O2)n
(donde X es el elemento metálico, O es oxígeno y n es la valencia del elemento metálico).
Los peróxidos son combinaciones binarias del oxígeno con ciertos metales. Son derivados de óxidos que contienen la agrupación -O-O-, O22- llamado ión peróxido.
Nomenclatura:
Stock
Se pone la palabra "Peróxido" seguido de la palabra "de" y el nombre del metal y en número romano su Valencia (en caso de que tenga más de una).
SALES OXIGENADAS:
Las sales oxigenadas también llamadas oxisales se forman por reacción de un hidróxido con un oxácido. Es una reacción de neutralización en la que también se forma agua.
Como en toda neutralización el ácido pierde H+ y la base OH- con los que se forma agua. Al perder los H+ el ácido se transforma en un anión.
Nomenclatura:
Tradicional: cambia las terminaciones oso e ico de los ácidos por ITO y ATO, manteniendo los prefijos.
OSO ------- ITO
ICO -------- ATO
ELABORADO POR: GUADALUPE MERCADO NAVARRETE.
BIBLIOGRAFIA:
http://www.100ciaquimica.net/temas/tema4/punto5c.htm
http://clasesdequimica.blogspot.mx/2012/04/modelo-de-mar-de-electrones.html
http://slideplayer.es/slide/3139742/
Química General / Jean B. Umland, Jon M. Bellama
Química general / W. H. Slabaugh, T. D. Parsons
Química general / W. H. Slabaugh, T. D. Parsons


























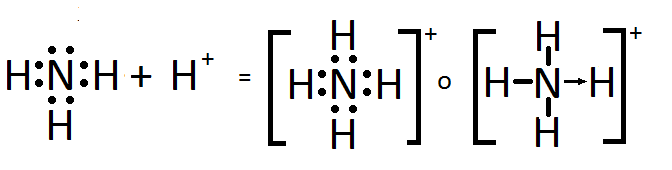





Muy buen trabajo, una sugerencia, anoten al final de cada información quien la desarrollo, de tal forma que se vean involucrados los participantes del equipo.
ResponderEliminarSaludos Cordiales
Hilda Cisneros